Внедрение технологий, основанных на выделении ДНК в научные и клинические исследования, открыло новую эру в неинвазивной пренатальной диагностике как в исследовательском, так и в практическом направлении.
Еще в 1999 г. было обнаружено почти 5-кратное повышение сэ-ДНК плода в кровотоке матери при преэклампсии по сравнению с группой женщин с нормально протекающей беременностью [1]. Было установлено, что при преэклампсии происходит выброс в материнский кровоток клеток синцитиотрофобласта, микрочастиц, молекул ДНК и РНК. Анализ данного материала может расширить понимание вклада плацентарных факторов в этиологию преэклампсии. При дальнейшем изучении этой патологии выявлен не только рост уровня сэ-ДНК, но и значительное повышение общего уровня ДНК матери, причем увеличение обоих показателей соответствовало степени тяжести преэклампсии [2]. Так как ДНК плазмы является маркером клеточной гибели, повышенный уровень фетальной ДНК может быть результатом некроза и апоптоза клеток плаценты. Существует гипотеза, согласно которой нарушение функции почек и печени, наблюдаемое при преэклампсии, ослабляет выведение циркулирующей ДНК из материнской крови. Однако позже было установлено, что кроме преэклампсии, повышение уровня сэ-ДНК происходит и при других акушерских осложнениях: преждевременных родах, плотном прикреплении плаценты, врастании плаценты, задержке роста плода, внутриматочных гематомах, плацентарной недостаточности [3–6].
Основным лимитирующим фактором в подобных исследованиях является сложность идентификации сэ-ДНК, отличие эмбриональной ДНК от материнской. Подобная проблема решаема у женщин, вынашивающих плоды мужского пола, в связи с наличием в кровотоке беременной маркеров Y-хромосомы – SRY и DYS-14. В этой связи большинство предыдущих исследований, посвященных прогнозированию неблагоприятных исходов беременностей по высокому уровню сэ-ДНК, включая проведенные нами работы, касались беременных, вынашивающих плоды мужского пола [7–9].
Исследование уровня сэ-ДНК у беременных независимо от пола плода в динамике неосложненной и патологически протекающей беременности носят неоднозначный, нередко противоречивый характер.
Проспективные исследования у женщин с привычными потерями беременностей в сравнении с пациентками с угрожающим спорадическим выкидышем и здоровыми беременными в доступной литературе найти не удалось.
Целью данного исследования было провести сравнительный анализ уровня сэ-ДНК в периферической крови женщин с угрожающим привычным выкидышем и здоровых беременных в сроках до 22 недель.
Материал и методы исследования
Проведено проспективное когортное исследование 57 беременных женщин. Основную группу составили 33 женщины с привычным выкидышем, контрольную – 24 беременные с неотягощенным акушерским и гинекологическим анамнезом.
Пациенток основной и контрольной групп включали в исследование в сроках 6 недель беременности от первого дня последней менструации. Критериями включения в основную группу были: нормальный кариотип партнеров, привычный выкидыш (наличие в анамнезе 3 и более потерь беременности до 22 недель от одного и того же партнера или 2 и более потерь, если в каждом случае был подтвержден нормальный кариотип плода), информированное согласие женщины на проведение исследования. Данные пациентки представляли собой группу риска не только по прерыванию беременности, но и по реализации поздних гестационных осложнений, ассоциированных с плацентацией. Известно, что наличие в анамнезе двух выкидышей повышает риск прерывания последующей беременности до 38%, трех выкидышей – до 45% [10]. Кроме того, установлено, что беременные с привычным выкидышем, а также пациентки с кровотечениями на ранних сроках беременности составляют группу риска по реализации плацентарной недостаточности, задержке роста плода (ЗРП), предлежанию плаценты, отслойкам плаценты, преждевременным родам [11].
Контрольную группу составили женщины с физиологическим течением беременности на момент обследования, неотягощенным акушерским и гинекологическим анамнезом, подписавшие информированное согласие на проведение исследования.
Критериями исключения в обеих группах были: многоплодная беременность, наличие хронических инфекционно-воспалительных, онкологических, системных аутоиммунных заболеваний, тяжелые экстрагенитальные заболевания, ожирение (индекс массы тела более 30), кроме того, в основной группе – наличие генетических и анатомических причин привычного выкидыша.
Подобные критерии исключения продиктованы ограничениями метода определения сэ-ДНК, к которым относятся:
- Ожирение беременной, когда фракция сэ-ДНК является крайне низкой;
- Исследование при дихориальной двойне, когда интерпретация данных затруднена, так как уровень сэ-ДНК значимо выше и несопоставим с уровнем при одноплодной беременности;
- Материнские факторы, например, онкологическое заболевание, сопровождающееся массивным выбросом опухолевой ДНК.
Исследование проводилось у пациенток основной и контрольной групп, начиная со срока 6 недель беременности, с интервалом 2 недели до 20 недель беременности.
Определение сэ-ДНК, независимо от пола плода, проводилось методом ПЦР в режиме реального времени (real time PCR). В качестве «мишени» выбирались участки генома, содержащие делеционные полиморфизмы, что позволяло отличить геном плода от генома беременной женщины на основании отцовских полиморфизмов.
Все полученные данные были обработаны с помощью компьютерной программы Statistica for Windows v. 8.0.

Для всех количественных показателей были определены: среднее значение (M), стандартное отклонение (δ), ошибка среднего (m), 95% доверительный интервал, медиана (Ме), интерквартильный размах, а для номинальных значений рассчитаны частоты (%).
Полученные данные были проверены на соответствие нормальному распределению с помощью критерия Шапиро–Уилка, поскольку данные не были распределены нормально, то при сравнении средних значений между группами применяли непараметрический аналог t-критерия Стьюдента – U-критерий Манна–Уитни.
Сравнение распределения показателей (частот) между группами осуществлялось с помощью критерия χ2 с построением соответствующих таблиц (2×2 или 2×3) или с помощью t-критерия Стьюдента для долей с поправкой Бонферони.
Различия считались статистически значимыми при p<0,05.
Определение зависимости между показателями осуществлялось с помощью корреляционного анализа Пирсона (r) или непараметрического критерия Спирмена (R).
Результаты исследования и их обсуждение
В группах беременных женщин с привычным выкидышем и в контрольной группе было произведено определение свободной эмбриональной ДНК, динамическое наблюдение, анализ осложнений и исходов беременностей до 22 недель.
Самым частым осложнением в I триместре у женщин исследуемых групп был угрожающий и начавшийся выкидыш, подтвержденный данными опроса, осмотра, эхографического исследования. Диагноз «угрожающий выкидыш» ставился только в случае наличия кровянистых выделений из половых путей, что свидетельствовало о начавшейся отслойке хориона формирующейся плаценты.
Проводимая терапия, включала гестагены (дидрогестерон 40 мг), спазмолитики, гемостатики (при кровотечении).

В исследование вошли 57 беременных, из них 24 женщины контрольной группы и 33 женщины с привычным выкидышем в анамнезе.
Средний возраст женщин основной и контрольной групп достоверно не отличался и составил у женщин с привычным выкидышем – 28,2±5,9 года, у здоровых беременных – 29,6±5,2 года.
При изучении наследственности установлено, что у 18,5% (10 женщин) она была отягощена онкологическими заболеваниями, у 25,4% (13 женщин) – сахарным диабетом II типа и у 9,6% (6 женщин) – инфарктом миокарда у родителей.
Установлено нарастание уровня сэ-ДНК во всех группах женщин с увеличением срока беременности. Подобные данные были получены для женщин, вынашивающих плоды мужского пола, что свидетельствует об увеличении доли сэ-ДНК в периферической крови матери с каждой последующей неделей беременности. Этот факт имеет важное практическое значение в определении сроков проведения неинвазивной пренатальной диагностики анеуплоидий по уровню сэ-ДНК. Выбор срока для данной диагностической процедуры зависит от необходимого и достаточного уровня сэ-ДНК в периферической крови беременной женщины.
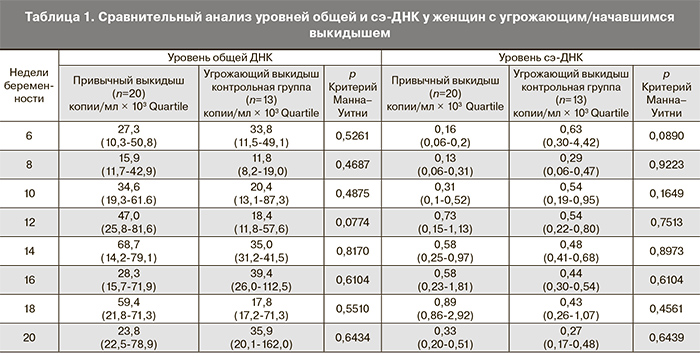
При анализе уровня сэ-ДНК беременных с угрожающим выкидышем было установлено, что средние значения у женщин с привычным выкидышем и со спорадически возникающей угрозой прерывания беременности без отягощенного анамнеза достоверно не различались на всех гестационных сроках (табл. 1). Отмечена даже тенденция к более высокому уровню сэ-ДНК в группе женщин с не осложненным анамнезом и начавшимся выкидышем в сроке 6 недель, однако данные изменения не были достоверными. Возможно, это свидетельствует о едином патогенетическом механизме, возникающем при угрожающем и начавшемся выкидыше у женщин как с отягощенным анамнезом, так и с неосложненной акушерской историей. Согласно полученным результатам, апоптотические выбросы в материнский кровоток сэ-ДНК трофобластического происхождения имеют место при угрожающем и начавшемся выкидыше как универсальный механизм, возникающий при отслойке хориона.
У пациенток с привычным и начавшимся выкидышем уровень общей ДНК был несколько выше в сроке 12 недель (47,0×103 (25,8-81,6) копий/мл по сравнению с 18,4×103 (11,8-57,6) копий/мл (p=0,0774), что может отражать общие апоптотические процессы в организме на данном сроке беременности.
 С другой стороны, при неосложненном течении первой половины беременности у женщин с привычным выкидышем и здоровых беременных получены достоверные различия в уровне сэ-ДНК. При отсутствии клинической картины угрожающего выкидыша, тем не менее, уровень сэ-ДНК пациенток с неоднократными потерями беременностей значительно превышает аналогичный показатель здоровых беременных женщин в сроках 12 и 14 недель (табл. 2).
С другой стороны, при неосложненном течении первой половины беременности у женщин с привычным выкидышем и здоровых беременных получены достоверные различия в уровне сэ-ДНК. При отсутствии клинической картины угрожающего выкидыша, тем не менее, уровень сэ-ДНК пациенток с неоднократными потерями беременностей значительно превышает аналогичный показатель здоровых беременных женщин в сроках 12 и 14 недель (табл. 2).
Можно предположить, что подобные «скрытые» апоптотические изменения трофобласта, зарегистрированные несмотря на проводимое лечение, служат основой для формирования в дальнейшем поздних гестационных осложнений: плацентарной недостаточности, ЗРП, преждевременного досрочного родоразрешения.
При проведении анализа внутри группы женщин с привычным выкидышем с угрозой и без угрозы прерывания беременности уровень общей ДНК статистически значимо отличался лишь в сроках 12 и 20 недель. Интересно, что данные сроки беременности совпадают с общепринятыми для биохимического и ультразвукового скрининга (табл. 3.). Уровень сэ-ДНК достоверно отличался в сроках 12 и 14 недель, что, вероятно, отражает апоптотические изменения во время инвазии трофобласта. Полученные данные подлежат дальнейшему изучению и анализу на поздних гестационных сроках.
В группе женщин с неотягощенным акушерским анамнезом (контрольной группе) выявлены достоверные различия среди пациенток с начавшимся выкидышем и неосложненным течением данной беременности. Данные изменения касались уровня и общей, и сэ-ДНК. По показателям общей ДНК достоверные различия получены в сроках 6, 10, 12, 14, 16 недель, по сэ-ДНК – в 10 и 14 недель (табл. 4.)
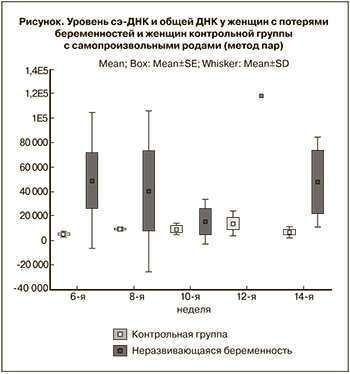
У 7 женщин из 33 женщин (21,2%) группы с привычным выкидышем произошли самопроизвольные потери беременности. В 5 из 7 случаев причиной послужили анеуплоидии – трисомия 18, триплоидии в 3 случаях, моносомия по Х хромосоме. Отдельно были проанализированы данные сэ-ДНК и общей ДНК у 7 женщин с потерями беременностей и 7 женщин контрольной группы с самопроизвольными родами (метод пар). Данные представлены на рисунке.
Как видно из представленных данных, уровень сэ-ДНК в 6 недель беременности достоверно отличался у женщин с неразвивающимися беременностями и пациенток, беременность которых была пролонгирована до срока своевременных родов. Возможно, дальнейшие исследования в данной области позволят предложить уровень общей и сэ-ДНК как возможный прогностический критерий пролонгирования беременности у женщин с привычным выкидышем. Подлежит дальнейшему исследованию уровень сэ-ДНК на ранних сроках беременности как прогностический маркер поздних гестационных осложнений.
Заключение
Выявлена взаимосвязь клинических проявлений угрожающего и начавшегося выкидыша с высоким уровнем общей и сэ-ДНК независимо от анамнеза пациентки. У женщин с привычным выкидышем и неосложненным течением первой половины беременности уровень сэ-ДНК статистически значимо выше, чем у здоровых беременных, что может предрасполагать к реализации плацента-ассоциированных гестационных осложнений. У женщин с привычным выкидышем при неблагоприятном течении беременности в сроках 12 и 20 недель беременности уровень сэ-ДНК достоверно выше, чем при отсутствии клинической картины угрожающего выкидыша. Полученные данные подлежат дальнейшему анализу для уточнения роли описанных изменений в реализации поздних гестационных осложнений и возможностей их применения в клинической практике.



