Акушерские и перинатальные аспекты аутоиммунного тиреоидита (АИТ) активно изучаются в последние десятилетия, что обусловлено, с одной стороны, высокой распространенностью данной патологии среди женщин репродуктивного возраста, с другой – пониманием, какая важная роль принадлежит тиреоидным гормонам в обеспечении нормального течения беременности и вынашивания здорового ребенка [1, 2].
Однако если особенности течения беременности и родов при АИТ изучены достаточно полно, то данные о состоянии здоровья младенцев, рожденных от матерей с АИТ, немногочисленны и нередко противоречивы, а сведения об отдаленных показателях физического развития, соматического здоровья и тиреоидного статуса этих детей практически отсутствуют.
Наиболее широко в литературе освещены вопросы влияния гипотиреоза и материнской гипотироксинемии на интеллектуальное и нервно-психическое развитие детей. Доказано, что декомпенсированный на ранних стадиях беременности гипотиреоз приводит к нарушению формирования центральной нервной системы (ЦНС) плода, что проявляется отставанием психомоторного развития детей и снижением индекса интеллектуального развития в отдаленные после рождения сроки [3, 4].
 Несколько противоречивы данные о влиянии АИТ на антропометрические показатели новорожденных. Одни авторы отмечают высокий процент гипотрофии среди новорожденных от матерей с АИТ [5], другие – отсутствие негативного влияния АИТ на ростовесовые показатели новорожденных [6]. В.В. Фадеев [7] указывает, что вероятность развития гипотрофии у новорожденных зависит от степени компенсации гипотиреоза при беременности. Среди особенностей раннего неонатального периода у детей, рожденных от матерей с гипотиреозом, выделяют гипербилирубинемию, анемию, кардиопатию, поражение ЦНС и морфофункциональную незрелость [8]. К отдаленным последствиям гипотиреоза некоторые авторы относят нарушения полового созревания и высокую заболеваемость [9]. Таким образом, значение АИТ при беременности до недавнего времени рассматривалось в основном в аспекте негативного влияния гипотиреоза, который традиционно признавался ведущим звеном в патогенезе акушерских и перинатальных осложнений при АИТ. В последнее время роль аутоиммунных тиреопатий все чаще обсуждается в контексте генерализованной иммунной дисфункции организма, следствием которой является продукция не только антитиреоидных антител, но и некоторых других, в частности антифосфолипидных. Наличие последних может приводить к реализации тромбофилических состояний в плаценте и, как следствие, к ее дисфункции [10, 11]. Нарушение клеточного и гуморального иммунитета при АИТ может также являться причиной снижения фето-материнской толерантности [12].
Несколько противоречивы данные о влиянии АИТ на антропометрические показатели новорожденных. Одни авторы отмечают высокий процент гипотрофии среди новорожденных от матерей с АИТ [5], другие – отсутствие негативного влияния АИТ на ростовесовые показатели новорожденных [6]. В.В. Фадеев [7] указывает, что вероятность развития гипотрофии у новорожденных зависит от степени компенсации гипотиреоза при беременности. Среди особенностей раннего неонатального периода у детей, рожденных от матерей с гипотиреозом, выделяют гипербилирубинемию, анемию, кардиопатию, поражение ЦНС и морфофункциональную незрелость [8]. К отдаленным последствиям гипотиреоза некоторые авторы относят нарушения полового созревания и высокую заболеваемость [9]. Таким образом, значение АИТ при беременности до недавнего времени рассматривалось в основном в аспекте негативного влияния гипотиреоза, который традиционно признавался ведущим звеном в патогенезе акушерских и перинатальных осложнений при АИТ. В последнее время роль аутоиммунных тиреопатий все чаще обсуждается в контексте генерализованной иммунной дисфункции организма, следствием которой является продукция не только антитиреоидных антител, но и некоторых других, в частности антифосфолипидных. Наличие последних может приводить к реализации тромбофилических состояний в плаценте и, как следствие, к ее дисфункции [10, 11]. Нарушение клеточного и гуморального иммунитета при АИТ может также являться причиной снижения фето-материнской толерантности [12].
Цель: изучение влияния АИТ у беременных на показатели здоровья детей в раннем неонатальном периоде и в течение первого года жизни.
Материал и методы исследования
Обследованы 72 беременные с сопутствующим АИТ, состоявшие на диспансерном учете в женских консультациях г. Перми (1-я группа). Критерием постановки диагноза АИТ стало наличие первичного гипотиреоза (в том числе в анамнезе) в сочетании с ультразвуковыми маркерами АИТ и/или присутствующими в крови антитиреоидными антителами. Группу сравнения (2-я группа) составили 22 беременные, не имевшие анамнестических и клинических данных о заболеваниях щитовидной железы (ЩЖ). Для оценки тиреоидного статуса использовались клинические методы исследования (оценка клинической симптоматики, осмотр и пальпация ЩЖ), определение в крови уровня гормонов: тиреотропного гормона (ТТГ), свободного тироксина (Т4св.), антител к тиреопероксидазе (АТ-ТПО) и тиреоглобулину (АТ-ТГ) на иммуно-хемилюминисцентном анализаторе закрытого типа «Immulite 2000» с использованием диагностических наборов фирмы «Siemens» (референтный интервал значений ТТГ при беременности составляет 0,2–3,0 мкМЕ/мл, Т4св. – 0,7–1,48 нг/дл, АТ-ТПО – 0–35 МЕ/л, АТ-ТГ – 0–100 МЕ/л), ультразвуковое исследование ЩЖ с цветным допплеровским картированием на аппарате Sonoscape SS1-5000. Для выявления соматического, наследственного и акушерско-гинекологического анамнеза использовался метод анкетирования. Изучение особенностей течения беременности и родов проводилось по данным индивидуальной карты беременной и родильницы (форма №111/у). Для оценки общего состояния здоровья детей (антропометрические данные, особенности течения периода новорожденности, наличие перинатального поражения ЦНС, внутриутробной инфекции, соматической патологии и перенесенных острых заболеваний в течение 1-го года жизни) использовались данные выписки из роддома и истории развития ребенка (форма N 112/у).
 Статистическая обработка полученных данных проводилась с помощью пакета анализа табличного процессора Microsoft Excel, для оценки различий применялся двухвыборочный t-критерий, различия считались достоверными при p<0,05. Для оценки зависимости двух качественных признаков использовался корреляционный анализ с вычислением коэффициента сопряженности Пирсона (Ki). О силе связи судили по величине Ki: 0,00<Ki<0,30 – зависимости нет, 0,31<Ki<0,70 – умеренная, 0,71<Ki<1,00 – выраженная.
Статистическая обработка полученных данных проводилась с помощью пакета анализа табличного процессора Microsoft Excel, для оценки различий применялся двухвыборочный t-критерий, различия считались достоверными при p<0,05. Для оценки зависимости двух качественных признаков использовался корреляционный анализ с вычислением коэффициента сопряженности Пирсона (Ki). О силе связи судили по величине Ki: 0,00<Ki<0,30 – зависимости нет, 0,31<Ki<0,70 – умеренная, 0,71<Ki<1,00 – выраженная.
Результаты и обсуждение
Средний возраст в основной и контрольной группах был сопоставим и составил 28,24±0,49 и 27,95±1,01 года соответственно. Профессиональную вредность в виде контакта с вредными химическими соединениями имели 18 (25,0±3,4%) человек в основной и 1 (8,3±5,5 %) в группе сравнения (p<0,05). У 40 (55,6±4,3%) беременных с АИТ и 7 (33,3±9,4%) группы сравнения был выявлен отягощенный семейный анамнез по заболеваниям щитовидной железы (p<0,05). Соотношение перво- и повторнородящих в исследуемых группах существенно не отличалось. Так, в основной группе были 41 (56,8±5,8%) первородящая и 31 (43,2±5,8%) повторнородящая женщина, в контрольной – 14 (62,5±9,7%) и 8 (37,5±9,8%) соответственно (p>0,05). Репродуктивный анамнез, отягощенный невынашиванием беременности, имели 28 (38,9±3,8 %) пациенток с АИТ и 6 (29,2±9,1%) пациенток контрольной группы (p<0,05). Гинекологические и экстрагенитальные заболевания в анамнезе одинаково часто наблюдались в основной и контрольной группах. Таким образом, сравниваемые группы были сопоставимы по возрасту, месту жительства, социальному статусу, паритету родов, гинекологическому и соматическому анамнезу. Однако у пациенток 1-й группы в анамнезе достоверно чаще отмечались выкидыши и неразвивающиеся беременности, профессиональная вредность, а также заболевания ЩЖ у близких родственников.
У 70 пациенток основной группы беременность закончилась срочными родами, у 1 – преждевременными и 1 – запоздалыми. Среди доношенных новорожденных 10 (14,3±4,2%) детей имели признаки задержки внутриутробного развития (ЗВУР) по гипотрофическому типу. В контрольной группе все беременности завершились срочными родами, и не было зарегистрировано ни одного случая ЗВУР среди новорожденных (р<0,01). Антропометрические характеристики детей при рождении в сравниваемых группах не имели достоверных различий. Так, вес в основной группе составил 3386,08±61,62 г, в контрольной – 3441,55±73,69 г (р>0,05), рост – 51,39±0,30 см и 51,68±0,34 см соответственно(р>0,05).
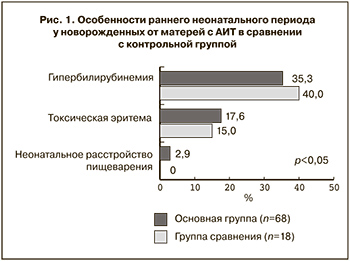
Анализ течения раннего неонатального периода не выявил каких-либо особенностей постнатальной адаптации у детей, рожденных от матерей с АИТ. Такие парафизиологические состояния, как токсическая эритема, гипербилирубинемия, неонатальное расстройство пищеварения встречались с одинаковой частотой в основной и контрольной группах (рис. 1).
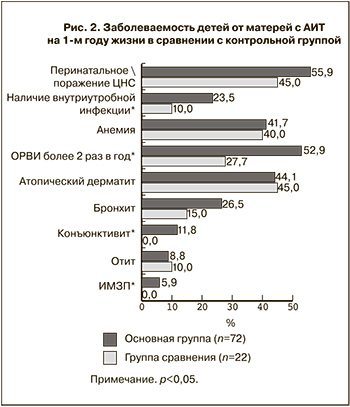
Перинатальное поражение ЦНС было диагностировано у 55,9±6,0% новорожденных основной группы и 45,0±10,9% контрольной (рис. 2). Частота данной патологии в Российской Федерации по данным разных авторов варьирует от 5–30 до 715 случаев на 1000 детей в возрасте до одного года [13, 14].
Такие неоднозначные статистические данные обусловлены нечеткостью критериев неврологической нормы и переходных состояний от нормы к патологии применительно к новорожденным. К патологическим состояниям нередко относят транзиторные физиологические явления со стороны нервной системы новорожденных, которые встречаются у половины здоровых новорожденных и исчезают в течение первых семи дней жизни. В нашем исследовании мы использовали данные выписки из роддома и истории развития ребенка. Выявленная частота перинатального поражения ЦНС во многом зависела от критериев диагностики, принятых в педиатрической службе г. Перми. Однако целью нашего исследования являлось не определение частоты данной патологии как таковой, а сравнение ее в разных клинических группах. В результате было установлено, что в группе с АИТ перинатальное поражение ЦНС регистрировалось несколько чаще, чем в группе сравнения, но это различие не было достоверным (р>0,05). Подавляющее большинство случаев перинатального поражения ЦНС у обследованных новорожденных обеих групп имело гипоксический генез и проявлялось синдромом двигательных дисфункций легкой и средней степени тяжести.
 Анализ заболеваемости детей на 1-м году жизни показал высокую распространенность внутриутробной инфекции, ассоциированной с цитомегаловирусом, среди детей основной группы: 23,5±5,1% против 10,0±6,5% в контрольной (р<0,05). Дети, рожденные от матерей с АИТ, достоверно чаще болели острыми респираторно-вирусными инфекциями на первом году жизни: в среднем 2,78 случая на человека в год в основной группе и 1,66 – в контрольной (р<0,05), причем, в основной группе респираторные заболевания чаще протекали в более тяжелой форме. У детей 1-й группы также достоверно чаще регистрировались инфекции мочевыводящих путей и конъюнктивиты. Такая высокая склонность к инфекционным и воспалительным процессам, по-видимому, указывает на несостоятельность противоинфекционной защиты у детей, рожденных от матерей с АИТ. В отношении же анемии и других соматических заболеваний достоверных различий между основной и контрольной группами выявлено не было (рис. 2).
Анализ заболеваемости детей на 1-м году жизни показал высокую распространенность внутриутробной инфекции, ассоциированной с цитомегаловирусом, среди детей основной группы: 23,5±5,1% против 10,0±6,5% в контрольной (р<0,05). Дети, рожденные от матерей с АИТ, достоверно чаще болели острыми респираторно-вирусными инфекциями на первом году жизни: в среднем 2,78 случая на человека в год в основной группе и 1,66 – в контрольной (р<0,05), причем, в основной группе респираторные заболевания чаще протекали в более тяжелой форме. У детей 1-й группы также достоверно чаще регистрировались инфекции мочевыводящих путей и конъюнктивиты. Такая высокая склонность к инфекционным и воспалительным процессам, по-видимому, указывает на несостоятельность противоинфекционной защиты у детей, рожденных от матерей с АИТ. В отношении же анемии и других соматических заболеваний достоверных различий между основной и контрольной группами выявлено не было (рис. 2).
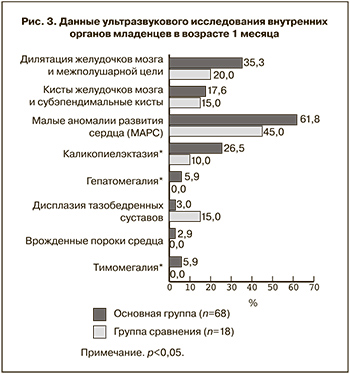
Сравнительный анализ данных ультразвукового исследования внутренних органов детей в возрасте 1 месяца (рис. 3) показал, что в основной группе чаще встречались дилатация желудочков мозга и межполушарной щели, малые аномалии развития сердца: открытое овальное окно, дополнительная хорда левого желудочка и аневризма межпредсердной перегородки, а также каликопиелэктазия, гепатомегалия и тимомегалия. По последним трем показателям имелось достоверное различие в сравниваемых группах. У двух новорожденных основной группы (2,9±2,0%) были выявлены врожденные пороки сердца: умеренный стеноз легочной артерии и дефект межпредсердной перегородки.
С целью выявления факторов, которые при беременности имеют наибольшее прогностическое значение в отношении состояния здоровья детей у матерей с АИТ, мы сравнили между собой показатели здоровья новорожденных в нескольких подгруппах основной группы. При формировании подгрупп учитывались следующие параметры: функциональное состояние ЩЖ при беременности, уровень АТ-ТПО, длительность приема препаратов йода при беременности.
Для оценки степени влияния гипотиреоза при беременности на показатели здоровья детей мы сравнили две группы пациенток с АИТ, в одной из которых (n=36) во время беременности сохранялся стойкий эутиреоз (то есть показатели ТТГ не превышали 2,5 мкМЕ/мл в I триместре, 3,0 мкМЕ/мл – во II и III триместрах), а в другой (n=36) – хотя бы однократно был зафиксирован гипотиреоз, манифестный или субклинический. У детей пациенток 2-й группы чаще регистрировались ЗВУР по гипотрофическому типу, перинатальное поражение ЦНС и внутриутробное инфицирование, но эти различия не были статистически достоверными. Средний вес новорожденных составлял 3491,00±68,39 г в группе с эутиреозом и 3304,05±93,68 г – в группе с гипотиреозом (р>0,05). Отсутствие достоверных различий в сравниваемых группах, возможно, связано с тем, что при выявлении гипофункции ЩЖ при беременности сразу назначалась заместительная терапия L-тироксином, в результате чего достигался медикаментозный эутиреоз и возможные негативные эффекты гипотиреоза сводились к минимуму.
Аналогичным образом было проведено сравнение 2 групп беременных с различным уровнем антитиреоидных антител. В 1-ю группу (n=37) вошли беременные с АИТ, имеющие относительно невысокий уровень антитиреоидных антител, превышающий верхнюю границу нормы не более чем в 10 раз (уровень АТ-ТПО составлял 36–350 МЕ/мл при норме 0–35 МЕ/мл). Во 2-ю группу (n=35) вошли беременные с высоким уровнем АТ-ТПО (более 350 МЕ/мл). У пациенток с высоким уровнем антител достоверно чаще наблюдалась ЗВУР новорожденных: в 21,1±6,6% случаев против 5,6±3,8% – у пациенток с относительно низким уровнем АТ-ТПО (р=0,049). По остальным показателям состояния здоровья детей достоверных различий в сравниваемых группах выявлено не было.
По длительности приема препаратов йода все пациентки с АИТ также были разделены на две группы: с ранним началом йодной профилактики (на этапе прегравидарной подготовки или до 12 недель беременности) и с поздним началом йодной профилактики (после 12 недель беременности или совсем не получавшие йодной дотации). Таким образом, в 1-й группе (n=38) длительность йодной профилактики составила 7–12 месяцев, во 2-й (n=34) – 0–6 месяцев. Антропометрические показатели новорожденных в этих группах не имели достоверных различий: средний вес составил 3444,68±67,69 г в 1-й группе и 3320,59±106,36 г – во 2-й (р>0,05). Перинатальное поражение ЦНС значительно реже отмечалось в 1-й группе по сравнению со 2-й: 47,4±8,1% и 66,7±8,7% соответственно, что, однако, не достигало степени достоверности (р=0,11). Частота внутриутробного инфицирования, острых респираторно-вирусных инфекций и соматической патологии у детей сравниваемых групп была сопоставима. Между тем, были выявлены некоторые различия в ультразвуковой характеристике ЩЖ у детей в возрасте 1 года. Средний объем ЩЖ был одинаков и составил 1,02±0,09 см3 в 1-й группе и 0,99±0,06 см3 во 2-й. В 1-й группе не было выявлено никаких эхографических особенностей строения ЩЖ. Во 2-й группе у 38,9±11,2% детей была отмечена неоднородная эхоструктура ЩЖ, что достоверно отличалось от показателей 1-й группы (р=0,009), а у 16,7%±8,5 было зарегистрировано усиление васкуляризации паренхимы ЩЖ, что, однако, не имело достоверных отличий от 1-й группы (р=0,16).

Для выявления значимости того или иного параметра тиреоидного статуса беременных в формировании ЗВУР новорожденных по гипотрофическому типу был проведен корреляционный анализ с вычислением коэффициента сопряженности Пирсона. В результате, установлена умеренная степень зависимости частоты ЗВУР от уровня АТ-ТПО при беременности (таблица). Также зарегистрирована отчетливая тенденция к формированию ЗВУР при наличии гипотиреоза у матери, не достигающая, однако, степени достоверности (р=0,051). Не выявлено зависимости ЗВУР от времени начала йодной профилактики. Таким образом, в тиреоидном статусе беременных с АИТ наиболее значимым фактором формирования ЗВУР оказался высокий уровень АТ-ТПО.
Заключение
В результате исследования установлено, что пациентки с АИТ имеют высокий риск рождения детей с синдромом ЗВУР по гипотрофическому типу. При этом частота выявления гипотрофии коррелирует в большей степени с уровнем антитиреоидных антител, в меньшей степени – с наличием гипотиреоза при беременности. Возможно, отсутствие значимого влияния гипотиреоза на антропометрические показатели новорожденных в нашем исследовании связано со своевременной и адекватной коррекцией гипофункции ЩЖ, выявленной на ранних сроках беременности. Тот факт, что высокий уровень антитиреоидных антител в крови матери является фактором риска рождения детей с ЗВУР по гипотрофическому типу, может косвенно подтверждать теорию о роли аутоиммунных механизмов в патогенезе плацентарной дисфункции у пациенток с АИТ.
Исследование показало, что наличие АИТ при беременности не оказывает существенного влияния на течение раннего неонатального периода, частоту перинатального поражения ЦНС и соматической патологии у младенцев в случае адекватной коррекции гипотиреоза при беременности. Однако дети, рожденные от матерей с АИТ, являются группой высокого риска по развитию внутриутробной инфекции и относятся к категории часто болеющих детей. Отсутствие адекватной йодной профилактики при беременности у пациенток с АИТ, в первую очередь, негативно влияет на состояние ЩЖ у детей, что подтверждается результатами эхографического исследования. В частности, отмечается наличие структурных изменений ткани ЩЖ в виде неоднородности эхоструктуры и усиления васкуляризации паренхимы. Недостаточное поступление йода при беременности у пациенток с АИТ не оказывает значимого влияния на ростовесовые показатели и соматическое здоровье детей, но ассоциируется с более высокой частотой перинатального поражения ЦНС.



