В качестве одной из причин, приводящих к развитию такой патологии раннего гестационного периода, как привычный выкидыш, рассматривается слабая аллогенная стимуляция иммунной системы матери антигенами плода отцовского происхождения. В частности, наличие у супругов совпадающих аллелей генов системы гистосовместимости человека HLA, уменьшающее взаимную аллогенную стимуляцию, обсуждалось как аллоиммунный фактор, приводящий к нарушению нормального протекания беременности [1, 2].
Для усиления специфического ответа лимфоцитов женщины на аллоантигены партнера в период предгестационной подготовки в супружеских парах с привычным выкидышем, используется процедура иммунизации женщин лимфоцитами полового партнера [3, 4]. Эта процедура проводится как в парах с совместимостью по HLA-антигенам, так и при привычном выкидыше неясного генеза при исключении других причин и подтверждении аллоиммунного фактора. Один из показателей формирования ответа иммунной системы женщины на введение аллогенных клеток – появление в сыворотке крови антител к HLA-антигенам лейкоцитов: антиотцовских антител (АОАТ). Однако мнения о возможности использования АОАТ в качестве маркера эффективности иммунотерапии привычного невынашивания беременности противоречивы [1, 4]. Возможно, одной из причин противоречивых представлений о значимости АОАТ является отсутствие единого метода их определения [5]. Кроме того, продукция антител при использовании последовательных иммунизаций является динамичным процессом, развивающимся в течение нескольких месяцев при предгестационной подготовке и, возможно, при наступлении беременности. Поэтому выбор оптимального срока тестирования также может быть ключевым фактором при прогнозировании эффективности иммуноцитотерапии (ИЦТ) с помощью выявления уровня АОАТ. До сих пор динамика продукции антител при аллоиммунизации до беременности не изучалась.
Выявление аллогенных антител в сыворотке реципиента, способных связываться с поверхностными антигенами лимфоцитов, с помощью проточной цитофлуорометрии широко используется в трансплантологии для выявления предсуществующих антител, являющихся фактором риска при пересадке органов [6]. Метод определения АОАТ с помощью проточной цитофлуорометрии заключается в определении связывания флуоресцентно-меченых антител к иммуноглобулину G женщины с антителами на поверхности лимфоцитов партнера. Развитие многоцветной флуорометрии привело к усовершенствованию метода, и определило возможность выявления антител на определенных субпопуляциях иммунокомпетентных клеток [7]. Об использовании этих подходов для выявления АОАТ сообщалось лишь в единичных работах [8].
 Целью настоящей работы было оценить динамику выработки АОАТ-антител на фоне иммунизации женщин с привычным выкидышем клетками полового партнера как в период предгестационной подготовки, так и в первом триместре наступившей беременности, с помощью современных подходов, используемых в трансплантологии.
Целью настоящей работы было оценить динамику выработки АОАТ-антител на фоне иммунизации женщин с привычным выкидышем клетками полового партнера как в период предгестационной подготовки, так и в первом триместре наступившей беременности, с помощью современных подходов, используемых в трансплантологии.
Материал и методы исследования
Группу исследования составили 53 женщины с двумя и более потерями беременности в анамнезе, происходившими в первом триместре.
В контрольной группе было обследовано вне беременности 20 фертильных женщин без соматических заболеваний с неотягощенным акушерским анамнезом, имеющих последнего ребенка не старше 2 лет, а также 7 женщин с физиологическим течением первой беременности.
Критериями включения в исследование были: подписание формы информированного согласия на участие в исследовании, возраст женщины от 20 до 40 лет, самопроизвольное наступление беременности, нормозооспермия у партнера, отсутствие у женщин аутоиммунных, гормональных нарушений, тяжелых экстрагенитальных заболеваний, отсутствие ИЦТ в анамнезе.
Критериями включения в группу пациенток с привычным выкидышем были: наличие не менее 2 выкидышей ранних сроков от одного и того же партнера (если в каждом случае был подтвержден нормальный кариотип абортуса), нормальный кариотип партнеров, отсутствие анатомических и эндокринологических факторов потерь беременности.
В качестве подготовки к беременности женщинам с привычным выкидышем была назначена процедура ИЦТ – иммунизация женщин аллогенными клетками партнеров. Во время предгестационной подготовки пациенткам дважды с интервалом в один месяц на 5–9-й день менструального цикла подкожно вводили 50 млн клеток лейкоцитарной взвеси партнера в ладонную поверхность предплечья в 10–12 точек. Во время наступившей беременности ИЦТ проводили дважды с интервалом в один месяц на сроке в 5–6 недель и 8–9 недель согласно протоколу ведения беременности у пациенток с привычным выкидышем [3].
Определение наличия АОАТ в периферической крови женщин с привычным выкидышем проводили до назначения лечения, во время предгестационной подготовки и в первом триместре наступившей беременности.
Кровь у женщин для анализа забирали натощак из локтевой вены до назначения лечения и после каждого введения клеток на 18–22-й день менструального цикла. Во время наступившей беременности кровь забирали на сроке 5–6, 8–9 и 11–12 недель.
На момент написания статьи беременность после проведенной предгестационной подготовки наступила у 25 женщин, что составило 47% всех иммунизированных пациенток.
Лимфоциты из цельной крови партнеров выделяли стандартным методом центрифугирования в градиенте плотности с использованием смеси фиколл-верографин плотностью 1,077 [9]. Сыворотку крови женщин получали после образования в течение 30 минут при комнатной температуре кровяного сгустка, который осаждали центрифугированием при 900g в течение 10 минут. Перед проведением анализа сыворотку инактивировали нагреванием в течение 30 минут при 56°С.
АОАТ определяли методом перекрестного реагирования с помощью проточной цитометрии [10].
Для этого мужские лимфоциты инкубировали с женской сывороткой. Уровень АОАТ в сыворотке женщины соответствует доле мужских лимфоцитов, покрытых антителами к Fc-фрагменту иммуноглобулина G. В качестве контроля неспецифического связывания использовали инактивированную пулированную АВ-сыворотку (Sigma, США). Меченые флюоресцеин изотиоцианатом вторичные антитела к Fc-фрагменту иммуноглобулина G человека, использованные в работе, были той же фирмы. Определяли долю покрытых антителами Т-лимфоцитов, которые выявляли с помощью моноклональных антител к CD3, меченых фикоэритрином (Beckman Coulter, США). Анализ проводили на проточном цитофлуориметре FacsCalibur (Beckton Dickinson, США).
Статистическую обработку данных производили с использованием пакета статистического анализа для Microsoft Office Exсel 2007. Данные представлены как среднее±ошибка среднего (М±m). Достоверность различий средних значений расчетных показателей оценивали с помощью двухвыборочного t-теста с различными дисперсиями.
Результаты исследования
 Представлены данные проспективного исследования.
Представлены данные проспективного исследования.
В контрольной группе первобеременных женщин в течение первого триместра гестации не было выявлено АОАТ.
В результате проведенной работы нами не обнаружено различий в уровне АОАТ у женщин с привычным выкидышем до назначения лечения и в группе фертильных здоровых женщин (16,6±3,5, n=53 и 24,2±6,7, n=20).
Результаты АОАТ у женщин с привычным выкидышем во время предгестационной подготовки и во время наступившей беременности представлены на рис. 1.
Как видно из рис. 1, до назначения иммунизации уровень АОАТ у женщин с привычным выкидышем был низким. Проведение процедуры ИЦТ приводит к постепенному значимому повышению уровня АОАТ по сравнению с исходным. Уровень АОАТ, достигнутый после второй процедуры ИЦТ, сохраняется стабильным у забеременевших в дальнейшем женщин на протяжении всего первого триместра.
Отличий уровня АОАТ после последней иммунизации вне беременности от уровней АОАТ на разных сроках первого триместра не выявлено.
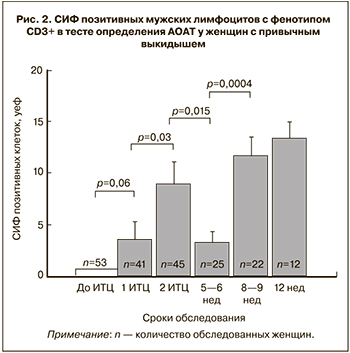
Нами проанализирована средняя интенсивность флуоресценции (СИФ) позитивных партнерских клеток в тесте АОАТ – показатель, характеризующий количество антител на одной клетке. Данные представлены на рис. 2.
Обнаружена динамика СИФ, отражающая результаты проведения процедуры иммунизации женщин партнерскими лимфоцитами. Так, отмечен постепенный рост СИФ-позитивных клеток после первой и второй ИЦТ вне беременности, а также после иммунизации в 5–6 недель и в 8–9 недель наступившей беременности. Значимое снижение СИФ после последней процедуры вне беременности можно объяснить тем, что сроки наступления беременности у всех пациенток были разными, интервал ожидания беременности был до одного года.
Обсуждение
До настоящего времени актуальна концепция, рассматривающая иммунологические процессы при беременности с точки зрения блокирования функций цитотоксических лимфоцитов и преимущественного развития аллоантительного ответа [10]. Поэтому образование АОАТ является одной из наиболее изученных гуморальных аллогенных реакций во время беременности. У женщин с физиологическим течением беременности в целом регистрируется низкий уровень антител, но они могут быть обнаружены начиная с 28-й недели гестации [11]. Есть данные о том, что в первом триместре беременности антитела зарегистрированы у 5% женщин с нормально протекающей беременностью и у 10% женщин с привычным выкидышем [9]. Установлено, что АОАТ определяются у много рожавших женщин [12].
В нашем исследовании в контрольной группе первобеременных в течение первого триместра гестации мы не зарегистрировали АОАТ.
Считается, что во время беременности АОАТ имеют особую структуру, вследствие чего их обозначают как ассиметричные антитела [13]. Показано, что увеличению пропорции ассиметричных антител способствуют цитокины Th2-функциональной направленности. Этот факт согласуется с данными об относительном превалировании Th2-ответа во втором триместре беременности и о выявлении АОАТ при физиологической беременности в начале третьего триместра [12, 14].
Считается, что АОАТ во время беременности выполняют защитную роль, поскольку они неспособны активировать эффекторные механизмы (комплемент-зависимую цитотоксичность, фагоцитоз).
С другой стороны, в акушерско-гинекологической практике показано, что введение аллогенных лимфоцитов для дополнительной иммунизации женщин с нарушениями репродуктивной функции аллоиммунного генеза при подготовке к беременности способствует формированию состояния иммунной системы, необходимого для протекания процесса имплантации, стимуляции развития плаценты, обеспечения нормального развития эмбриона [15]. Уровень АОАТ в женской сыворотке может быть одним из показателей, отражающих развитие специфического ответа лимфоцитов женщины на аллоантигены после иммунизации.
Нами показана динамика появления АОАТ в сыворотке крови во время предгестационной подготовки, заключающаяся в постепенном повышении их уровня до максимального от процедуры к процедуре. Во время наступившей беременности уровень АОАТ сохраняется на максимуме (93,2±2,1%) еще и благодаря иммунизации, которая проведена пациенткам согласно протоколу ведения беременности у женщин с привычным выкидышем два раза – в 5–6 и 8–9 недель гестации.
На наш взгляд, требуются дальнейшие исследования, чтобы установить, являются ли АОАТ фактором, влияющим на течение беременности; являются ли АОАТ антителами к антигенам НLA–I и/или НLA–II класса и как зависит продукция АОАТ от совместимости супружеской пары по HLA-антигенам I и II класса.
Заключение
Исходя из полученных результатов, можно заключить, что высокий уровень АОАТ у женщин с привычным выкидышем является следствием проведенной иммунизации аллогенными клетками партнеров. Высокий уровень АОАТ сохраняется до конца первого триместра беременности. Полученные результаты свидетельствуют о значимости теста АОАТ как отражающего иммуномодулирующее действие процедуры введения аллогенных клеток партнера. Необходимы дальнейшие исследования, чтобы определить возможность использования данного показателя для оценки эффективности ИЦТ привычного выкидыша.



