Привычная потеря беременности ранних сроков (привычный выкидыш) – диагноз, который, согласно определению ВОЗ, устанавливается в случае произошедших подряд трех и более самопроизвольных прерываний беременности на сроке гестации до 22 недель (код N96 по МКБ-10). Установлено, что женщины с привычным выкидышем на ранних сроках гестации составляют группу риска, в которой существенно повышена вероятность развития плацентарной недостаточности, наступления ранних преждевременных родов, задержки роста плода, излития околоплодных вод при недоношенном сроке беременности, отслойки плаценты во втором и третьем триместрах беременности [1, 2].
Ключевую роль в развитии привычного выкидыша неясного генеза, или идиопатического привычного выкидыша (от 5 до 20% в структуре невынашивания), играют аллоиммунные нарушения [3].
По данным зарубежных авторов, шанс доносить беременность без терапии после трех выкидышей, обусловленных аллоиммунными механизмами, составляет 30%, после четырех – 25%, после пяти – 5% [4, 5].
Поэтому в настоящее время наличие даже двух последовательных выкидышей рассматривается как основание для постановки диагноза «привычный выкидыш», последующего обязательного обследования, в том числе и иммунологического, и оптимизации подготовки к беременности [6].
Показано, что иммуноцитотерапия (ИЦТ) – введение аллогенных лимфоцитов с целью иммунизации женщин с привычным выкидышем при подготовке к беременности (особенно в супружеских парах с совместимостью по HLA-антигенам) способствует формированию состояния иммунной системы, необходимого для успешной имплантации, а во время беременности – для стимуляции развития плаценты и обеспечения нормального развития эмбриона [7, 8].
ИЦТ широко используется для коррекции привычного невынашивания беременности как в России [9, 10], так и за рубежом [11, 12], однако механизмы влияния аллоиммунизации на имплантацию и последующую гестацию остаются неизученными.
Долгое время считалось, что одним из результатов иммунотерапии является подавление агрессивных эффекторных реакций материнской иммунной системы, выражающееся в снижении содержания субпопуляций клеток с естественной киллерной активностью и в продукции блокирующих антител.
Особую значимость в последнем десятилетии приобрели исследования субпопуляции Т-регуляторных клеток с фенотипом CD4+CD25+ и конститутивной экспрессией фактора Foхр3+ (Трег). Считается, что осуществляемая Трег специфическая иммуносупрессия, способствует формированию состояния толерантности, необходимого для реализации гестационных процессов в первом триместре беременности [13]. В связи с этим обсуждается точка зрения, что целью иммунотерапии должна быть не иммуносупрессия, а стимуляция толерантности к аллоантигенам плода отцовского происхождения [14].
Показано, что важная роль в иммунорегуляции принадлежит толерогенной молекуле СD200. В результате взаимодействия CD200 с рецепторами как дендритных клеток, так и клеток с естественной киллерной активностью индуцируется секреция индоламиндиоксигеназы, и они приобретают способность посредством продукции ТФР-β (трансформирующего фактора роста-β) стимулировать генерацию Трег клеток и, соответственно, индуцировать формирование специфической периферической толерантности [15–18].
Исследований, посвященных одновременной оценке особенностей субпопуляций с киллерной активностью, Трег и клеток, несущих CD200, на фоне предгестационной ИЦТ не проводилось.
Целью настоящей работы стало исследование динамики субпопуляционного состава лимфоцитов периферической крови, включая субпопуляции киллерных клеток с различным фенотипом, естественных Трег и клеток, экспрессирующих CD200, в процессе предгестационной ИЦТ женщин с привычным выкидышем аллоиммунного генеза.
Материал и методы исследования
Основную группу исследования составили 52 женщины с двумя и более потерями беременности от одного партнера в анамнезе (если в каждом случае был подтвержден нормальный кариотип плода), произошедшими в первом триместре беременности.
Критериями включения женщин в исследование были: подписание формы информированного согласия на участие в исследовании, возраст женщины от 20 до 40 лет, самопроизвольное наступление беременности, нормальный кариотип обоих партнеров, нормозооспермия у партнера, отсутствие анатомических, генетически обусловленных, аутоиммунных, гормональных нарушений, препятствующих наступлению и вынашиванию беременности, отсутствие тяжелых экстрагенитальных заболеваний.
В контрольной группе были обследованы вне беременности 15 фертильных женщин без соматических заболеваний с неотягощенным акушерско-гинекологическим анамнезом, имеющие одного ребенка не старше 2 лет или более одного ребенка, последний из которых не старше 2 лет.

В качестве подготовки к беременности женщинам с привычным выкидышем была назначена процедура ИЦТ – иммунизация аллогенными клетками партнеров, которую проводили дважды с интервалом в один месяц на 5–9-й день менструального цикла. При этом пациенткам подкожно вводили 50 млн клеток лейкоцитарной взвеси партнера в ладонную поверхность предплечья в 10–12 точек.
Кровь у женщин для анализа забирали натощак из локтевой вены до иммунизации и после каждого введения клеток на 18–22-й день менструального цикла.
Поверхностный фенотип клеток периферической крови определяли с помощью стандартного набора моноклональных антител, меченных флуоресцеин-изотиоцианатом (FITC) или фикоэритрином (PE), против антигенов CD3, CD4, CD5, CD8, CD16, CD19, CD16, CD56, CD200 (Becton Dickinson и eBioscience, США). Оценивали содержание основных субпопуляций иммунокомпетентных T-клеток (СD3+, CD4+, CD8+), В-клеток (CD19+), B1-клеток (CD19+CD5+), NK-клеток (СD56+, СD16+), а также содержание Трег (СD4+CD25highCD127low/-). Лимфоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью моноклональных антител к СD45, меченных перидинин-хлорофилл протеином (Per-CP) (Dako, Дания). Для оценки процентного содержания Трег использовали набор, содержащий моноклональные антитела к антигенам CD4, меченые Per-CP (eBioscience, США), CD25, меченые FITC (Becton Dickinson, США) и СD127, меченые PE (eBioscience, США). Моноклональные антитела добавляли непосредственно к цельной крови, затем лизировали с помощью раствора FACS Lysing Solution (Becton Dickinson, США). Анализ проводили с использованием проточного цитофлуориметра FACSСalibur (Becton Dickinson, США).
Статистическую обработку данных производили общепринятыми методами вариационной статистики. Данные представлены как среднее±ошибка среднего. Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Колмогорова–Смирнова с использованием пакета Statistica 6 для Windows XP.
Значимость наблюдаемых отклонений средних значений измеренных параметров оценивали с помощью двухвыборочного t-критерия Стьюдента с различными дисперсиями для средних значений с использованием пакета статистического анализа для Microsoft Office Excel 2007.
Результаты исследований
Было проанализировано содержание лимфоцитов различных фенотипов в периферической крови женщин с привычным выкидышем до назначения лечения и после каждой процедуры аллоиммунизации. Результаты исследования представлены в таблице.
Из таблицы следует, что двукратная аллоиммунизация существенно не влияла на содержание основных субпопуляций лимфоцитов, за исключением некоторых колебаний в содержании субпопуляций клеток с цитотоксической функцией. После первой процедуры значимо уменьшилось содержание лимфоцитов с фенотипом CD56+, CD3-CD56,16+, CD56,16+, а в содержании лимфоцитов с фенотипом CD3+CD16+ была отмечена тенденция к уменьшению (р=0,066). После 2-й процедуры содержание лимфоцитов с фенотипом CD56+ и с фенотипом CD3-CD56,16+ вернулось к исходным значениям, содержание лимфоцитов с фенотипом CD56,16+ осталось меньшим по сравнению с исходными значениями, а содержание лимфоцитов с фенотипом CD3+CD16+ увеличилось по сравнению с уровнем после первой процедуры, но без отличий от исходного уровня.
В предыдущих исследованиях нами было показано, что содержание лимфоцитов различных фенотипов различается у женщин с привычным выкидышем и здоровых [19]. Сравнение динамики субпопуляций лимфоцитов женщин с привычным выкидышем в процессе предгестационной подготовки и содержания лимфоцитов в крови женщин контрольной группы отражено на рисунке.
При проведении иммунизации не менялись выявленные до ее начала отличия в содержании основных субпопуляций Т-лимфоцитов (CD4+, CD8+, CD19+), лимфоцитов с киллерной функцией (CD56+, CD3-CD56,16+, CD56,16+, CD3+CD16+) и регуляторных клеток от нормативных значений. Лишь относительное содержание субпопуляций клеток с фенотипом CD3+CD56,16+ стало сходным с содержанием в контрольной группе после первой процедуры иммунизации. Однако после 2-й процедуры аллоиммунизации различия с контролем восстановились. Такая же динамика была выявлена при оценке абсолютного содержания лимфоцитов с фенотипом CD56,16+.
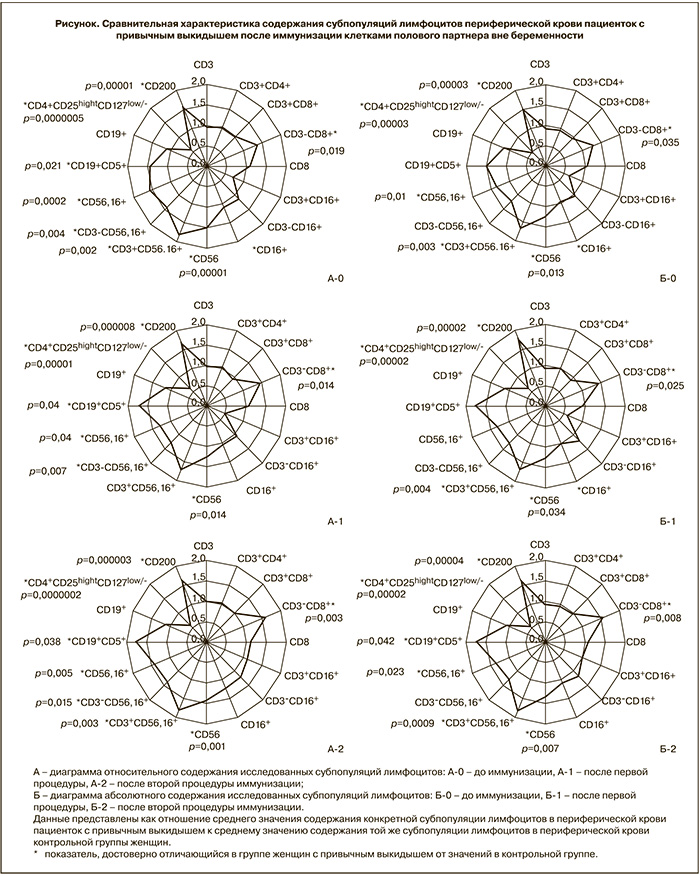
Обнаружено также, что после иммунизации увеличилось по сравнению с контролем абсолютное содержание B1-лимфоцитов с фенотипом CD5+CD19+.
Обсуждение
ИЦТ имеет не менее чем 30-летнюю историю применения и исследования ее механизмов. Однозначного вывода об ее эффективности не сделано до настоящего времени, поскольку протоколы иммунизации в различных клиниках мирового сообщества отличаются друг от друга, как и показатели, используемые для оценки ее влияния на состояние иммунной системы [3, 20–22].
Существует точка зрения, согласно которой механизм реализации выкидыша неясной этиологии аналогичен реакциям острого отторжения чужеродного трансплантата [3, 22]. Поскольку ключевая роль в реакциях отторжения принадлежит клеточным иммунным реакциям, то перспективы диагностики иммунных нарушений при привычном выкидыше и перспективы поиска маркеров эффективности иммунотерапии традиционно связывают с оценкой содержания в периферической крови субпопуляций клеток с естественной киллерной активностью.
Ранее было установлено, что иммунизация клетками полового партнера женщин с привычным выкидышем на самых ранних стадиях первого триместра приводит к снижению содержания киллерных клеток с фенотипом CD56+, что ассоциировалось с успехом этой процедуры в лечении привычного выкидыша [9, 23, 24].
На основании этих данных было высказано предположение, что проведение аллоиммунизации не только во время беременности, но и при подготовке к беременности женщин с привычным выкидышем будет способствовать успешному протеканию процессов имплантации и дальнейшему развитию беременности.
Предварительные клинические наблюдения позволили создать протокол «Подготовка и ведение беременности при аллоиммунных нарушениях», в котором рекомендуется проведение ИЦТ пациенткам до беременности в двух циклах с контролем содержания лимфоцитов с киллерной функцией [25]. В представленной работе использовалась схема проведения ИЦТ, предложенная в указанном протоколе.
Нами показано, что после первой процедуры иммунизации наблюдалось значимое снижение содержания клеток с цитотоксической функцией и фенотипом CD56+, CD3-CD56,16+, CD56,16+, и тенденция к снижению содержания лимфоцитов с фенотипом CD3+CD16+. После второй иммунизации сниженным осталось только содержание лимфоцитов с фенотипом CD56,16+, содержание остальных киллерных субпопуляций не отличалось от исходного уровня. При этом отличия содержания перечисленных субпопуляций от контроля, выявленные до иммунизации, после двукратной иммунизации не изменились.
Также в результате двух последовательных процедур иммунизации не было выявлено значимых изменений в содержании основных субпопуляций лимфоцитов (CD4+, CD8+, CD19+), Трег и экспрессии CD200.
До настоящего времени нет однозначного мнения об изменениях в субпопуляционном составе лимфоцитов периферической крови женщин с привычным выкидышем после аллоиммунизации. Противоречивы результаты оценки содержания в периферической крови клеток с киллерной функцией [26, 27]. Показано как отсутствие изменений в содержании Трег [28], так и повышение их содержания при аллоиммунизации [29].
Причиной отличий полученных результатов могут быть как отсутствие стандартных протоколов иммунизации, так и методические особенности, связанные с подготовкой периферической крови женщин к анализу. В ранее проведенных исследованиях была использована фракция мононуклеарных клеток периферической крови, полученная с помощью сепарации крови в градиенте плотности различных сред. Существенным отличием нашей работы является использование цельной крови, исключающее избирательную потерю отдельных субпопуляций лимфоцитов, а также оптимизированной схемы фенотипирования лимфоцитов [30].
В представленной работе обнаружено значимое увеличение абсолютного содержания В1-лимфоцитов с фенотипом CD5+CD19+, что может свидетельствовать о влиянии иммунизации на состояние гуморального иммунитета.
Известно, что большинство антител, секретируемых В1-лимфоцитами, специфично к собственным белкам организма (ДНК, антигенам групп крови и др.) и многие из них полиреактивны. В норме эти антитела имеют низкое сродство к антигенам, включая аутоантигены, и не способны вызывать повреждение тканей.
Признаком активации В-клеточного звена иммунитета является также появление антиотцовских антилейкоцитарных антител в крови пациенток после иммунизации [22, 31].
Таким образом, нельзя исключить, что иммунизация влияет на состояние активации лимфоцитов основных субпопуляций, что, в свою очередь, может определять функциональные особенности Трег [15, 16].
Очевидно, что перспективы изучения влияния процедур иммунизации пациенток с привычным выкидышем клетками полового партнера в предгестационной подготовке на состояние иммунной системы связаны с исследованием маркеров активационного состояния лимфоцитов различных субпопуляций, а также с контролем продукции аутоантител и антиотцовских антител, что явится предметом наших дальнейших исследований.
Заключение
В процессе предгестационной подготовки проведена двукратная иммунизация клетками полового партнера 52 женщин с привычным выкидышем аллоиммунного генеза. Выявлены изменения в содержании лимфоцитов с киллерной функцией и фенотипом CD56+, CD3-CD56,16+, CD56,16+, CD3+CD16+, а также увеличение абсолютного содержания лимфоцитов с фенотипом CD5+CD19+. Значимой динамики основных субпопуляций лимфоцитов (CD4+, CD8+, CD19+), клеток, несущих CD200, Трег не обнаружено. Перспективы дальнейших исследований связаны с изучением маркеров активационного состояния лимфоцитов различных субпопуляций.



