Кальций и такие микроэлементы как цинк, медь, марганец и бор принципиально необходимы для быстрого и эффективного заживления ран. Данные молекулярно-фармакологических исследований показывают, что при возникновении повреждения эпителиальной ткани происходит локализованное повышение уровней внутри- и внеклеточного кальция, которое принимает непосредственно участие в заживлении раны и восстановлении ткани [1]. Повреждение кожи вызывает быстрый ответ уровней кальция посредством сигнальной молекулы инозитол-1,3,4,5-тетракисфосфата, который играет важную роль в процессе заживления ран путем модуляции активности сигнальных белков Rho-ГТФаз. При этом, «волна» кальция распространяется от места повреждения к соседним неповрежденным клеткам [2]. Эти «волны» кальция также регулируют воспалительную реакцию посредством активации НАДФН-оксидазы DUOX и секреции перекиси водорода в области раны [3]. Кроме того, для заживления раны также важны и роли кальция в свертывании крови при повреждении эпителия. Отметим, что молекулярные механизмы участия кальция в заживлении ран достаточно сложны и являются предметом отдельного исследования.
В то время как кальций участвует в «общей организации» процесса заживления раны, ионы меди и марганца участвуют в процессах формирования соединительно-тканной основы кожи и, в частности, в синтезе коллагена. Медь участвует в модификации определенных лизиновых остатков коллагена и эластина, что имеет большое значение для формирования коллагеновых и эластиновых фибрилл кожи.
Медь, являясь кофактором фермента лизилоксидазы (ген LOX), имеет большое значение для формирования внутри- и межмолекулярных поперечных связей в коллагене. Поэтому, недостаток меди ухудшает формирование сшивок коллагена и связан нарушениями структуры коллагена [4–6].
 Действие марганца на соединительно-тканную основу кожи обусловлено воздействием дефицита марганца на структуру так называемой «гелеобразной среды», этого важнейшего компонента соединительной ткани. Гелеобразная среда образована протеогликанами – чрезвычайно растянутыми полипептидными цепями с многочисленными полисахаридными цепями глюкозаминогликанов, присоединенных посредством ковалентных связей.
Действие марганца на соединительно-тканную основу кожи обусловлено воздействием дефицита марганца на структуру так называемой «гелеобразной среды», этого важнейшего компонента соединительной ткани. Гелеобразная среда образована протеогликанами – чрезвычайно растянутыми полипептидными цепями с многочисленными полисахаридными цепями глюкозаминогликанов, присоединенных посредством ковалентных связей.
Установлено по меньшей мере три разновидности марганец-зависимых ферментов, которые принимают участие в синтезе глюкозаминогликанов и других углеводных компонентов протеогликанов. К этим ферментам относятся галактозилксилозил-глюкуронозил трансферазы, β-галактозил трансферазы и N-ацетилгалактозаминил трансферазы [7, 8]. В частности, N-ацетилгалактозаминил трансферазы (гены GALNT1…GALNT15) необходимы для синтеза глюкозаминогликанахондроитин сульфата: данная группа ферментов присоединяет N-ацетилгалактозамины к растущей полисахаридной цепи. Марганец-зависимые N-ацетилгалактоз-аминилтрансферазы необходимы для нормального развития соединительной ткани, а дефицит марганца приводит к разрушению конформации активного центра и резкому падению активности фермента.
Помимо меди и марганца, которые необходимы для синтеза соединительно-тканного матрикса и коллагенов, имеют важное значение цинк и бор. Цинк и медь – принципиально важные кофакторы ферментов, участвующих в синтезе различных молекулярных компонентов соединительной ткани. Цинк необходим для поддержания и дифференцировки остеобластов и синтеза коллагена. Также он регулирует уровень инсулиноподобного фактора роста (ИФР-1). Дефицит цинка приводит к нарушению синтеза ДНК и метаболизма белка, что ведет к нарушению синтеза всех компонентов соединительной ткани. Бор оказывает существенное воздействие на процессы роста клеток соединительной ткани (в частности, на процессы дифференцировки клеток), оказывая существенно воздействие на синтез коллагена в соединительно тканной основе кожи [9].
Таким образом, имеющие данные молекулярно-биологических исследований указывают на существование определенных механизмов воздействия кальция, цинка, меди, марганца, бора в поддержании структуры кожи и, следовательно, в процессе заживления ран. Целью настоящего исследования было экспериментальное изучение влияние препарата кальцемин адванс на заживление в модели резанной раны кожи.
Материал и методы исследования
Опыт проведен на 30 капюшонных крысах. До начала эксперимента было получено разрешение этического комитета ГБОУ ВПО ИвГМА на проведение данного исследования от 26.11.2014. Отбор крыс производился по следующим критериям: самцы, масса тела от 280 до 350 г, возраст 8–12 мес., отсутствие видимых повреждений, блестящие глаза, чистые кожные покровы, активные, с хорошим аппетитом. Животные содержались в индивидуальных пластиковых клетках при естественном освещении, при температуре воздуха около 20–22ºС и свободном доступе к пище и воде. Крысы были разделены на 2 серии по 15 животных.
На день 0 эксперимента все крысы были подвергнуты хлоралгидратному наркозу (350 мг/кг внутрибрюшинно). После наркоза животному проводилась депиляция на спине между лопаток и удалялся полнослойный участок кожи размером 1,5×1,5 см, причем края раны не ушивались. Затем в течение 21 суток рана не подвергалась местным воздействиям. Измерения площади раны проводили в обеих группах ежедневно, перед введением препарата или воды. Линейкой измерялись длина и ширина раны и вычислялось значение площади раны. Измерения и зондирование проводилось 5 раз в неделю.
После измерения размеров раны крысы зондировались. Контрольная группа получала 3 мл воды, опытная – 3 мл водной суспензии кальцемин адванс (из расчета 1 мл/100 г массы тела). Водная суспензия препарата приготовлялась посредством измельчения таблетки препарата и суспендирования в 50 мл воды.
Гистоморфологический анализ образцов кожи
Через 21 день после операции под хлоралгидратным наркозом у крыс забирался участок кожи с рубцом на месте повреждения. Кожный лоскут фиксировался в 10% растворе забуференного формалина. Проводка проводилась по стандартной схеме (обезвоживание в этиловом спирте, ксилоле). Затем проводилась парафиновая заливка образцов ткани, а после депарафинизации приготовлялись срезы на санном микротоме толщиной 5–6 мкм. Проводилось окрашивание микропрепаратов: гематоксилином и эозином, пикрофуксином по Ван Гизону. Микрофотографии получены с помощью исследовательского микроскопа «Micros» на анализаторе изображения «BioVision» (Австрия). В условиях заживления раны путем вторичного натяжения с формированием рубца были выбраны следующие морфологические критерии: (1) степень зрелости соединительной ткани; (2) выраженность воспаления в зоне повреждения; (3) уровень эпидермизации кожной раны и (4) степень васкуляризации (функциональные или запустевшие сосуды в 1 поле зрения при ув. х120).
Определение количества коллагена 1 в образцах кожи
Определение коллагена 1-го типа проводилось посредством иммуногистохимического анализа. Для этого депарафинизированные срезы ткани промывали натрий-фосфатным буфером, инкубировали с 0,3% перекисью водорода в течение 20 мин, чтобы блокировать активность эндогенной пероксидазы с последующей инкубацией с 5% бычьего сывороточного альбумина. Затем срезы инкубировали с оптимальными концентрациями первичных антител для COL-I (1:100; SigmaAldrich, Сент-Луис, США) в течение ночи при 4°С. После три раза промывали натрий-фосфатным буфером, срезы инкубировали с биотинилированные вторичными антителами в течение 20 мин перед инкубацией с конъюгированным с пероксидазой хрена авидинбиотиновым комплексом в течение еще 20 мин. Иммуноокрашивание визуализировали после добавления 3,3-диаминобензидин тетрагидрохлорида. Затем срезы прокрашивали гематоксилином Харриса в течение 40 сек, в пределах от 3 мин полосканий с водой. Срезы обезвоживали растворами этанола повышающихся концентраций и очищали в ксилоле. Образцы были исследованы под световым микроскопом Olympus (Япония). Для подтверждения результатов, каждый эксперимент был повторен три раза.
Результаты и обсуждение
 Использование синергидной комбинации кальция с цинком, медью, марганцем, бором, магнием и витамином D приводило к снижению среднего времени до полного заживления раны и улучшению динамики сокращения площади поверхности раны. Данные иммуногистохимического анализа указали на достоверное повышение содержания волокон коллагена 1 в области раны, а гистоморфологический анализ подтвердил ускорение процесса созревания рубцовой ткани и указал на улучшение эпителизации раны.
Использование синергидной комбинации кальция с цинком, медью, марганцем, бором, магнием и витамином D приводило к снижению среднего времени до полного заживления раны и улучшению динамики сокращения площади поверхности раны. Данные иммуногистохимического анализа указали на достоверное повышение содержания волокон коллагена 1 в области раны, а гистоморфологический анализ подтвердил ускорение процесса созревания рубцовой ткани и указал на улучшение эпителизации раны.
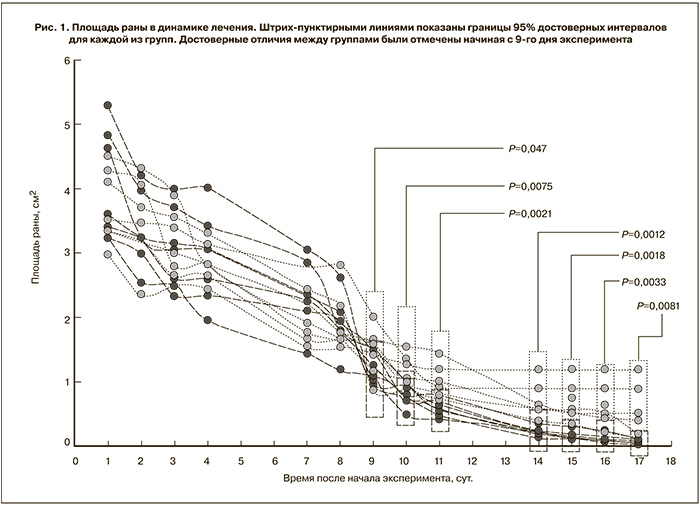
Среднее время полного заживления раны составило 21±5 сут в контрольной группе (вода) и 15±5 сут в опытной группе животных (кальцемин адванс). Таким образом, при приеме препарата среднее время до полного заживления раны было на 6 сут достоверно короче (P<0,05). Сокращение среднего времени до полного заживления сопровождалось ускоренной динамикой заживления раны. В табл. 1 приведены достоверные различия в площади раны в динамике лечения на 9–17-е сутки эксперимента. Различия между группами были достоверными начиная с 9-го дня эксперимента.
В контрольной группе умерли 2 животных и выведено из эксперимента одно (травмирование пищевода при зондировании); в опытной группе была выведена из эксперимента 1 крыса (агрессивное поведение). Эти различия не были достоверными. Поэтому для учета этих эффектов на достоверность отличий между группами после выведения из эксперимента было сохранено последнее зарегистрированное значение площади раны, которое и использовалось в расчетах. Положительная динамика изменений площади поверхности раны наглядно иллюстрируется при сравнении графиков динамики заживления ран индивидуальных животных в обеих группах (рис. 1).
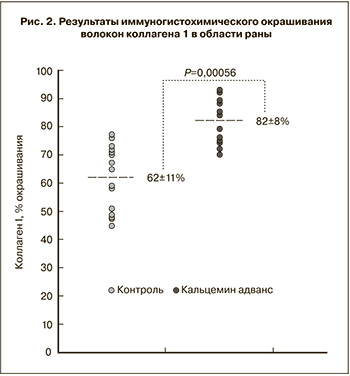
Повышенная скорость заживления раны при приеме синергидной комбинации кальция сопровождалась повышением содержания волокон коллагена 1 в области раны (рис. 2). В контрольной группе процент окрашивания коллагена составил 62±11%, а при приеме кальцемин адванс – 82±8% (то есть на 20% выше по сравнению с контролем, Р=0,00056).
Гистоморфологический анализ подтвердил ускорение процесса созревания рубцовой ткани и указал на снижение воспалительной реакции в созревающей соединительной ткани и улучшение эпителизации раны. В контрольной группе кожный дефект замещен рыхло волокнистой соединительной тканью. Коллагеновые волокна имели неравномерную окраску, местами дезориентированы (рис. 3 см. на вклейке).
В опытной группе (кальцемин адванс) практически во всех наблюдениях в зоне кожной раны сформировалась зрелая соединительная (рубцовая) ткань из мономорфных ориентированных коллагеновых волокон (рис. 4 см. на вклейке) и лишь в одном наблюдении кожный дефект был замещен рыхло-волокнистой соединительной тканью.
Гистоморфологический анализ позволил оценить степень эпителизации за счет анализа встречаемости кровеносных сосудов в области раны, отчего в значительной степени зависит заживление раны. Основным способом формирования сосудистой сети при заживлении раны является почкование капилляров, описание которого дано при изложении особенностей заживления ран вторичным натяжением. Возникающие при этом сосуды имеют строение синусоидов различного калибра и направления, расположенных обычно неравномерно и не ориентированных вертикально, как это характерно для грануляционной ткани.
В дальнейшем из сосудистых щелей при первичном натяжении формируются мелкие вены и артерии; собственно капилляров немного, они не соприкасаются с внешней средой, следовательно, не выделяют и не всасывают, то есть не выполняют функций, характерных для истинной грануляционной ткани. В конце фазы фиброплазии, когда в основном завершается образование соединительной ткани, новообразованные капилляры претерпевают обратное развитие, большинство из них регрессирует и исчезает [10]. Таким образом, в ране происходит превращение ткани, богатой кровеносными сосудами и активно делящимися клетками, в ткань, получившую название соединительнотканного рубца.
В контрольной группе по мере созревания грануляционной ткани до рубцовой количество новообразованных сосудов уменьшается за счет запустевания и спадения. Нами был проведен количественный анализ выраженности васкуляризации соединительной ткани в зоне кожной раны. В 10 полях зрения при увеличении в 120 раз подсчитывались сосуды с дифференцировкой на функционирующие (кровенаполненные) и запустевающие (отсутствие эритроцитов в их просветах). Среднее количество сосудов в одном поле зрения составило 43, из них 80% оставались функционирующими и 20% – запустевающими.
В то же время в опытной группе принимавших кальцемин адванс отмечено более интенсивное формирование соединительнотканного рубца: уровень васкуляризации новообразованной соединительной ткани оказался ниже в сравнении с группой контроля и составил в среднем 18 сосудов в одном поле зрения, среди которых доля функционирующих составил 43%, а доля запустевших и спавшихся сосудов – 57%.
Морфогистологический анализ также указал на снижение воспалительной реакции в созревающей соединительной ткани. В контрольной группе во всех наблюдениях отмечалась диффузная, умеренно выраженная воспалительно-клеточная инфильтрация, причем в составе инфильтрата наряду с лимфоцитами сохранялись нейтрофилы. Во всех наблюдениях контрольной группы поверхность кожной раны была полностью или частично покрыта струпом (редуцированный фибринозно-лейкоцитарный экссудат). Процесс эпидермизации оказался незавершенным в 3 наблюдениях (новообразованный многослойный плоский ороговевающий эпителий покрывал дефект лишь частично), а в 2 случаях покровный эпителий не был сформирован.
При приеме кальцемин адванс в формирующемся рубце сохранялась умеренно выраженная воспалительно-клеточная инфильтрация, которая носила очаговый характер, а клеточные инфильтраты были представлены преимущественно лимфоцитами (рис. 8, см. цветную вклейку).
В целом, при приеме кальцемин адванс в большинстве образцов поверхность кожной раны была полностью эпидермизирована и многослойный плоский ороговевающий эпителий имел четко выраженную стратификацию с отдельными участками кератинизации. Гистологически, полное рубцевание раны отмечено к 18–21-му дню наблюдения, а в контрольной группе – к 28–32-му дню.
Таким образом, при морфологическом анализе регенерации кожной раны у крыс, получавших препарат кальцемин адванс, выявлено ускорение процесса созревания рубцовой ткани в сравнении с контрольной группой. Воспалительная реакция в созревающей соединительной ткани крыс, получавших препарат, к 21-му дню эксперимента оказалась минимальной и выражалась очаговой лимфоцитарной инфильтрацией. Использование препарата оказало влияние на ускорение сроков эпидермизации кожной раны у опытных животных.
Заключение
Использование синергидной комбинации кальция с цинком, медью, марганцем, бором, магнием и витамином D приводило к снижению среднего времени до полного заживления раны и улучшению динамики сокращения площади поверхности раны. Данные иммуногистохимического анализа указали на достоверное повышение содержания волокон коллагена 1 в области раны, а гистоморфологический анализ подтвердил ускорение процесса созревания рубцовой ткани и указал на улучшение эпителизации раны.



