Проблема эффективного и безопасного консервативного лечения миомы матки остается актуальной. Этиология миомы матки, несмотря на длительную историю изучения, до сих пор остается не до конца изученной. Однако участие половых гормонов (эстрогенов и прогестеронов) в патогенезе заболевания уже убедительно доказано [1–3]. После выявления роли прогестерона в патогенезе миомы были предложены и в настоящее время с успехом используются препараты с антигестагенной активностью: мифепристон, азоприснил, улипристал [4–6]. Современные научные данные о фармакодинамических свойствах этих препаратов позволили их отнести к селективным модуляторам рецепторов прогестерона (СПРМ) [5, 6]. СМРП – это новый класс лигандов рецепторов прогестерона, который в зависимости от клеточного и тканевого контекста проявляют смешанную агонистическую или антагонистическую активность в клетках-мишенях [7].
Как и любые лекарственные препараты, селективные модуляторы рецепторов прогестерона имеют побочные эффекты. Наряду с классическими нежелательными явлениями – тошнота, головная боль и др., для СПРМ характерно развитие в эндометрии пациенток обратимых специфических изменений его железистого, стромального и сосудистого компонентов. Активация пролиферативных процессов в эндометрии на фоне лечения СПРМ, как показал многолетний опыт применения в клинической практике, принципиально отличается от патологической гиперплазии эндометрия, которая является фоновым состоянием канцерогенеза. Консенсус патоморфологов, посвященный данному вопросу, в 2006 году утвердил термин – Progesterone receptor modulators Associated Endometrial Changes (PAEC, изменения эндометрия, ассоциированные с терапией модуляторами рецепторов прогестерона). Вследствие своей уникальности и класс-специфичности РАЕС авторизованы в 2012 году Европейским Медицинским Агентством как самостоятельный вид обратимых морфологических изменений эндометрия [7–10]. В России РАЕС называют «железистая дилатация эндометрия», что вполне отражает ее суть.
Проявление РАЕС не связано с эффективностью лечения. Так, эффективность лечения миомы СПРМ в среднем составляет 85–95%, тогда как частота РАЕС – от 15 до 30% [8]. Нами ранее предложен маркер прогноза эффективности применения мифепристона в лечении миомы матки у конкретной пациентки (уровень мРНК ядерного глюкокортикоидного рецептора). Данный критерий не позволяет предсказать развитие РАЕС, для этого требуется дальнейшее изучение персональных особенностей рецепторного профиля пациенток с миомой матки.
Персонализированный подход в применении СМПР у пациенток с миомой является резервом повышения их комплаентности. Для этого, в зависимости от наличия или отсутствия изменений эндометрия ассоциированных с терапией модуляторами рецепторов прогестерона, необходим анализ данных ключевых молекулярно-фармакологических и биохимических параметров пациенток с выявлением потенциального маркера риска РАЕС для использования его в индивидуальном подборе терапии конкретной пациентки.
В качестве объекта исследования нами выбраны мононуклеарные клетки периферической крови (МНФК), которые в последнее время с успехом используются для мониторинга лечения гормонозависимых заболеваний репродуктивной системы женщины [11]. МНФК экспрессируют практически все рецепторы половых стероидных гормонов, что подтверждает эндокринный контроль иммунокомпетентных клеток [12]. Ранее нами показано, что в МНФК преобладает экспрессия следующих стероидных рецепторов: мембранный рецептор эстрадиола (mER), ядерный рецептор прогестерона типа А (PR-A), ядерные глюкокортикоидные (GR) и андрогеновые (AR) рецепторы [13].
Учитывая роль половых гормонов в патогенезе миомы матки и функциональное значение рецепторов стероидов в иммунокомпетентных клетках, нами в качестве молекулярно-фармакологических кандидатов выбраны параметры стероидно-рецепторного транскриптома клеток МНФ периферической крови пациенток с миомой матки до лечения мифепристоном.
Цель нашей работы: изучить экспрессию генов рецепторов эстрадиола (mER), прогестерона (PR-A), глюкокортикоидов (GR), андрогенов (AR) в мононуклеарной фракции крови пациенток с миомой матки с изменениями эндометрия, ассоциированными с терапией мифепристоном и без таковых.
Материал и методы исследования
В обследование были включены 50 пациенток в возрасте от 18 до 45 лет с миомой матки, соответствующей по величине от 6- до 12-недельной беременности с интерстициальной и интерстициально-субсерозной локализацией миоматозных узлов. Критериями исключения служили: субмукозное расположение миоматозного узла, миома матки размером более 12 недель беременности, мено- и метроррагии, вызывающие анемию (гемоглобин <90 4="" 1="" 90="" 30="" 30="" -="" p="">
Пациентки проходили обследование и терапевтическое лечение на базе Московского областного научно-исследовательского института акушерства и гинекологии и Национального медико-хирургического центра имени Н.И. Пирогова.
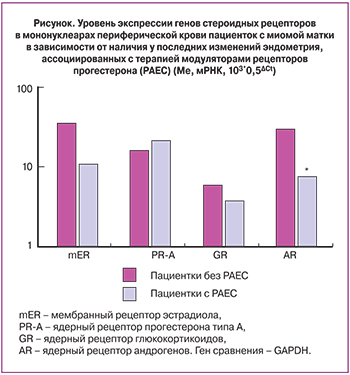
Все пациентки подписывали информированное согласие на участие в клинико-лабораторном исследовании. Пациенток, включенных в клиническое исследование, в зависимости от наличия или отсутствия изменений эндометрия, ассоциированных с терапией модуляторами рецепторов прогестерона, разделили на две группы. Характеристика групп представлена в табл. 1.
Безопасность лечения мифепристоном оценивали на основании регистрации нежелательных явлений путем анализа жалоб, симптомов. Контролировали толщину эндометрия при помощи УЗ-исследования, фиксировали степень выраженности его изменений.
В процессе рутинного обследования, наряду с бимануальным исследованием, использовали ультразвуковое сканирование (трансабдоминальное и трансвагинальное), позволяющее оценить исходные размеры матки, величину, расположение и структуру миоматозных узлов. С целью исключения патологии эндометрия в ряде клинических наблюдений до лечения производили гистероскопию, лечебно-диагностическое выскабливание матки, с последующим гистологическим исследованием полученного материала. После проведенного курса лечения мифепристоном изучали особенности восстановления менструального цикла, его характер, оценивали общее состояние, динамику клинических симптомов, размеров матки и миоматозных узлов. Мифепристон пациентки принимали внутрь, начиная с 1–2-го дня менструального цикла ежедневно, непрерывно в дозе 50 мг. Курс приема препарата 3 месяца.
 До курса лечения мифепристоном на 19–22-й день менструального цикла у пациенток забирали кровь из локтевой вены. Материалом для молекулярно-генетических исследований служили мононуклеарные клетки периферической крови. МНФК из цельной крови выделяли в градиенте плотности фиколла (плотность – 1,077, ПанЭко). Для получения мРНК использовали комплекс реагентов «Рибо-преп» (ИнтерЛабСервис, Россия), для синтеза кДНК на матрице мРНК комплекс реагентов – «Реверта-L» (ИнтерЛабСервис, Россия).
До курса лечения мифепристоном на 19–22-й день менструального цикла у пациенток забирали кровь из локтевой вены. Материалом для молекулярно-генетических исследований служили мононуклеарные клетки периферической крови. МНФК из цельной крови выделяли в градиенте плотности фиколла (плотность – 1,077, ПанЭко). Для получения мРНК использовали комплекс реагентов «Рибо-преп» (ИнтерЛабСервис, Россия), для синтеза кДНК на матрице мРНК комплекс реагентов – «Реверта-L» (ИнтерЛабСервис, Россия).
Уровень экспрессии генов рецепторов эстрадиола, прогестерона, андрогенов и глюкокортикоидов в МНФК изучали при помощи метода RT-PCR (IQ5 iCycler, Bio-Rad, США). В качестве референсных транскриптов использовали гены «домашнего хозяйства» (GAPDH). Уровень мРНК выражали в условных единицах (у.е.) = 0,5∆Ct. Количественный анализ экспрессии генов рецепторов производили по формуле 2-∆∆Ct [14]. Статистическую обработку осуществляли при помощи программы GraphPadPrizm 5. Проверку однородности исследуемых групп осуществляли при помощи критерия χ2, оценку достоверности различий между исследуемыми признаками проводили с использованием непараметрических методов статистики с использованием U-критерия Манна–Уитни. При проведении корреляционного анализа связи между параметрами внутри одной выборки использовали коэффициент ранговой корреляции Спирмена. Разница между значениями сравниваемых показателей считалась вероятной при р≤0,05. ROC-кривую строили для определения чувствительности и специфичности потенциального маркера.
Результаты
В исследование вошли 50 пациенток, женщины получали мифепристон (гинестрил) в дозе 50 мг/сут, внутрь, ежедневно, однократно, 3 месяца. Клиническая эффективность антигормональной терапии в нашем исследовании составила 86% (43 из 50). Изменениями эндометрия, ассоциированные с применением препарата, обнаружены у 11 из 50 (22%) пациенток. В результате морфологического исследования биопсий эндометрия пациенток с железистой дилатацией эндометрия ни одного случая атипической гиперплазии не было выявлено. Полученные цифры сходны с международными данными клинического применения мифепристона в терапии миомы матки [15–20].
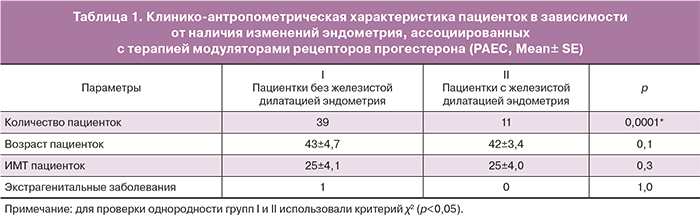
Результаты исследования экспрессии генов рецепторов эстрадиола (mER), прогестерона (PR-A), андрогенов (AR) и глюкокортикоидов (GR) в мононуклеарной фракции крови пациенток с миомой матки с изменениями эндометрия, ассоциированными с терапией мифепристоном и без таковых представлены на диаграмме (рисунок).
Как видно из данных диаграммы, в МНФК пациенток с измененным эндометрием на фоне применения мифепристона выявлено снижение экспрессии генов ядерных рецепторов андрогенов в 3,7 раза (р=0,03) по сравнению с аналогичным параметром в МНФК пациенток с неизмененным эндометрием. Уровень мРНК mER, PR-A и GRв МНФК пациенток не зависел от состояния эндометрия. Следовательно, уровень экспрессии AR может служить маркером прогноза риска развития РАЕС у пациенток с миомой матки на фоне терапии мифепристоном.
Корреляционный анализ экспериментальных данных с количественной оценкой мРНК ядерных рецепторов андрогенов в иммунокомпетентных клетках пациенток позволил выявить, что экспрессия AR в МНФК женщин имеет отрицательную корреляционную связь с развитием специфических изменений в структуре эндометрий на фоне терапии SMPR (CI 95% Spearman r=-0,37 (-0,64–-0,01), р=0,04). Вычисленное пороговое значение уровня экспрессии ядерного андрогенового рецептора в мононуклеарах периферической крови пациенток составил 0,028 (0,5∆Ct относительно GAPDH, RP-PCR). У пациенток со значением предложенного маркера ниже порогового уровня отмечено наибольшая вероятность проявления обратимых специфических изменений железистого, стромального и сосудистого компонентов эндометрия на фоне терапии мифепристоном. Определение диагностической ценности предложенного маркера (ROC-анализ) позволило определить его специфичность и чувствительность, которые составили 50 и 90%, соответственно. Площадь под ROC-кривой равна 0,74, что свидетельствует о хорошей прогностической значимости предложенного маркера.
Обсуждение полученных результатов
В нашем исследовании у 22% пациенток с миомой матки на фоне применения селективного модулятора рецепторов прогестерона – мифепристона были выявлены специфические и обратимые морфологические изменения эндометрия, детерминированные патоморфологами как PAEC – Progesterone receptor modulator Associated Endometrial Changes (изменения эндометрия, ассоциированные с модулятором рецепторов прогестерона). Полученные результаты соответствуют данным из многочисленных научно-медицинских источников литературы. РАЕС являются характерным и класс-специфическим изменением эндометрия, развивающимся под влиянием всех известных СМРП [21]. Изменения эндометрия обратимы и самостоятельно регрессируют в течение нескольких недель после завершения курса терапии.
Недостаточная информированность специалистов о проявлениях РАЕС может привести к ошибочной тактике ведения пациенток с миомой матки, снижению комплаентности и как следствие неэффективному лечению. Необоснованные оперативные вмешательства являются дополнительным фактором риска для репродуктивного здоровья женщины.
Проявление нежелательного явления мифепристона зависит от определенных характеристик конкретной пациентки. В частности, нами выявлено отличие в функциональных характеристиках клеток крови. У женщин с железистой дилатацией эндометрия на фоне применения мифепристона выявлено снижение экспрессии генов ядерных рецепторов андрогенов в иммунокомпетентных клетках. Следовательно, данный параметр можно использовать для выявления пациенток с высоким риском развития РАЕС.
Андрогены через собственные андрогеновые рецепторы (AR) в МНФК могут контролировать функцию иммунокомпетентных клеток, участвуют в реализации их активации, хемотаксиса и секреции провоспалительных факторов. В исследовании in vivo показано, что блокада AR вызывает увеличение числа про-B, пре-В и незрелых В-клеток в костном мозге [22]. Стероиды через AR модулируют численность и состав Т-клеток [23]. Дигидротестостерон уменьшает секрецию ФНО-α в ЛПС – индуцированных макрофагах селезенки, в то же время вызывая секрецию и ФНО-α, и ИЛ-6 клетками Купфера [24].
Тестостерон вызывает увеличение производства макрофагами активных форм кислорода [25].
Таким образом, мифепристон, влияя на транскрипционную активность AR в МНФК, по-видимому, участвует в иммунном контроле пролиферации гормон-зависимых тканей женщины.
Пациентки имеют возможность прогноза появления нежелательного явления антигормональной терапии. Женщины, психологически не готовые мириться с подобными проявлениями, имеют возможность выбрать альтернативный способ лечения.
Заключение
Выявлен маркер прогноза изменений эндометрия, ассоциированных с терапией модуляторами рецепторов прогестерона (мифепристона) у пациенток с миомой матки (уровень мРНК ядерных рецепторов андрогенов в мононуклеарах крови (RT-PCR)).



