Витамин D относится к жирорастворимым витаминам. Витамин D и его активные метаболиты являются структурными единицами гормональной системы, регулирующей не только фосфорно-кальциевый обмен, но и метаболические процессы. Активную роль витамин D играет в функционировании репродуктивной системы. Образующийся в печени метаболит 25 (ОН) D3, обладает выраженной активностью, уровень его в печени стабилен, отражает суммарное поступление витамина D с пищей и образование его в коже и в норме колеблется от 10 до 100 нг/мл. Наиболее активный метаболит витамина D3 – 1,25(ОН)2D3 синтезируется в почках в результате действия фермента 1α-гидроксилазы. Регуляция синтеза 1,25(ОН)2D3 осуществляется паратгормоном. Активирующее влияние на 1α-гидроксилазу оказывают половые стероиды (эстрогены, андрогены) [1]. В последние годы стало известно, что 1,25(ОН)2DЗ подавляет пролиферацию и ускоряет дифференцировку большого количества опухолевых клеток, которые вызывают экспрессию рецепторов к витамину D. В ближайшем будущем можно ожидать применения производных витамина D для моно- и комбинированной терапии многих опухолевых заболеваний (карцинома молочной железы человека, опухоли толстой кишки) [2].
Из года в год растет интерес к витамину D как фактору, влияющему на репродуктивную функцию. Накоплено много данных о снижении содержания витамина D в крови у женщин с различными нарушениями половой системы – синдромом поликистозных яичников (СПКЯ), бесплодием, миомой матки, эндометриозом, синдромом преждевременного истощения яичников, неудачами ЭКО [3]. Так Al-Hendy и соавт. (2015) обнаружили обратную корреляционную зависимость между сниженным уровнем экспрессии рецепторов к витамину D и повышенной экспрессией эстрогеновых рецепторов α и прогестероновых рецепторов А и В. Лечение витамином D приводило к значительному снижению экспрессии эстрогеновых и прогестероновых рецепторов в тканях миомы матки. Экзогенный 1,25(ОН)2DЗ индуцировал рецепторы к витамину D (VDR), что выражалось в повышении количества комплексов ретиноида-х (RXR) и рецептора-α. В данном случае витамин D выступает как активный антагонист рецепторов половых стероидов (эстрогенов и прогестерона) и мощный антиэстрогенный агент для лечения миомы матки [4]. С другой стороны, предполагается, что высокая концентрация кальциферола может быть связана с нарушением отторжения клеток эндометрия, попадающих в брюшную полость через маточные трубы, в результате чего развивается эндометриоз. При мужском бесплодии и низкие (<20> 50 нг/мл) концентрации витамина D в крови негативно влияют на количество сперматозоидов в одном миллилитре спермы, их поступательное движение и морфологию. [5]. Наблюдаются лучшие результаты ЭКО у больных без недостаточности витамина D, что объясняют высокой концентрацией витамина D и его метаболитов в децидуальной ткани человека собранной в 1-м триместре беременности и предполагают его вклад в надлежащее качество имплантации и местного иммунологического предпочтения эмбриона [6]. Рецепторы к витамину D обнаружены практически во всех тканях-мишенях организма. Влияние витамина D на органы половой системы женщины доказывает и тот факт, что экспрессия мРНК рецепторов к витамину D (VDR) определяется в тканях половых органов: в плаценте, миометрии, эндометрии, яичниках, в смешанных клетках яичников и в культурах очищенных клеток гранулезы, что указывает на роль в стероидогенезе половых гормонов. Обнаружено, что плацента человека экспрессирует ген CYP27B1 (кодирует 1α-гидроксилазу) и рецепторы к витамину D (VDR). Viganò и соавт. показали, что эндометрий способен экстраренально синтезировать активную форму витамина D [7] Кроме того, авторы показали, что активная форма гена 1α-гидроксилазы экспрессируется в человеческих стромальных эндометриальных клетках независимо от фазы цикла, но со значительным увеличением в начале беременности в децидуальной оболочке. В ткани яичников 1,25 (OH)2D3 стимулируют продукцию прогестерона на 13%, эстрадиола на 9%, а эстрона на 21%. Исследования, касающиеся обеспеченности витамином D пациенток с СПКЯ, проводятся во многих странах мира и обнаруживают снижение показателя даже там, где есть достаточное количество солнечного света.
Так, M. Irani и соавт. в 2014 г исследовали содержание витамина D в крови у 57 здоровых женщин и 20 больных с СПКЯ и обнаружили снижение уровня витамина D у женщин с СПКЯ менее 20 нг/мл, тогда как у здоровых пациенток уровень витамина D был нормальным и составил в среднем 34,6±2,8 нг/мл. Наличие СПКЯ подтверждалось значительным увеличением количества антимюллерова гормона (АМГ) в крови. Авторы предположили, что витамин D3 улучшает качество фолликулов у женщин с СПКЯ, о чем свидетельствует нормализация аномально повышенных уровней АМГ после проведенной терапии 50000 МЕ витамина D3 один раз в неделю в течение 8 недель (с 5,3±0,6 до 3,9±0,5, р=0,003) [8].
 По данным некоторых исследований показана высокая распространенность дефицита 25(ОН) D3 и связь низкого уровня витамина D и метаболических факторов риска, инсулинорезистентности и сниженной чувствительности к инсулину. Однако взаимоотношения между уровнем витамина D, генетическим состоянием его рецептора и частотой метаболического синдрома или отдельных его симптомов остаются противоречивыми. Проведенное исследование показало, что у женщин репродуктивного возраста дефицит витамина D и носительство А-аллеля ApaI полиморфизма его рецептора могут представлять собой неклассические факторы риска развития нарушений метаболизма [9]. Уровни 25 (OH) D3 в 30–45 нг/мл в крови, оптимальные для профилактики многих заболеваний и осложнений беременности, могут быть обеспечены ежедневными дозами от 2000 до 4000 МЕ. Тем не менее, в литературе не нашлось достаточно данных о содержании витамина D в крови у женщин с нарушением репродуктивной функции, проживающих в европейской части Российской Федерации. Все вышесказанное свидетельствует о необходимости дополнительного изучения роли витамина D в функционировании репродуктивной системы у женщин.
По данным некоторых исследований показана высокая распространенность дефицита 25(ОН) D3 и связь низкого уровня витамина D и метаболических факторов риска, инсулинорезистентности и сниженной чувствительности к инсулину. Однако взаимоотношения между уровнем витамина D, генетическим состоянием его рецептора и частотой метаболического синдрома или отдельных его симптомов остаются противоречивыми. Проведенное исследование показало, что у женщин репродуктивного возраста дефицит витамина D и носительство А-аллеля ApaI полиморфизма его рецептора могут представлять собой неклассические факторы риска развития нарушений метаболизма [9]. Уровни 25 (OH) D3 в 30–45 нг/мл в крови, оптимальные для профилактики многих заболеваний и осложнений беременности, могут быть обеспечены ежедневными дозами от 2000 до 4000 МЕ. Тем не менее, в литературе не нашлось достаточно данных о содержании витамина D в крови у женщин с нарушением репродуктивной функции, проживающих в европейской части Российской Федерации. Все вышесказанное свидетельствует о необходимости дополнительного изучения роли витамина D в функционировании репродуктивной системы у женщин.
Целью нашего исследования стала оценка уровня 25 (OH) D3 в крови и его влияния на развитие гормональных и метаболических нарушений у женщин с СПКЯ и нарушением репродуктивной функции.
Материал и методы исследования
Проведено обследование 45 женщин с нарушениями, характерными для СПКЯ, а именно олиго/аменореей, гиперандрогенией, ультразвуковыми признаками СПКЯ, бесплодием. Всем пациенткам проведено общеклиническое и ультразвуковое исследование, оценка конституциональных особенностей (рост, вес, индекс массы тела (ИМТ), отношение окружности талии к окружности бедер (ОТ/ОБ)), гормонального фона (ФСГ, ЛГ, ЛГ/ФСГ, пролактин, общий тестостерон, андростендион, глобулин связывающий половые гормоны (ГСПГ), АМГ в сыворотке крови). Для исключения патологии щитовидной железы и надпочечниковой гиперандрогении, которые также могут быть причиной нарушения репродуктивной функции, определены тиреотропный гормон, свободный тироксин, свободный трийодтиронин, антитела к тиреопероксидазе, паратгормон, дегидроэпиандростерон сульфат, 17-гидроксипрогестерон методом иммуноферментного анализа (ИФА). Больные с гиперпролактинемией, нарушением функции щитовидной железы и надпочечниковой гиперандрогенией исключались из исследования. Оценку степени гирсутизма проводили с помощью шкалы Ферримана–Галвея. По результатам комплексного исследования определяли фенотип СПКЯ. У всех пациенток исследовали содержание метаболита витамина D в сыворотке крови с помощью набора 25 (OH) D2 и D3 DIA SOURCE методом ИФА. Полученные результаты сравнивали с данными 15 здоровых женщин без нарушения менструальной и репродуктивной функции, которые составили группу сравнения. Математический анализ полученных результатов проводился с использованием стандартного набора функций статистической обработки с помощью пакета программ Exсel MS Office XP и Statistica 6.0.
Результаты исследования и обсуждение
Средний возраст пациенток не превышал 27±3,6 года, возраст менархе 13,42±1,49 года. Соматический анамнез обследованных был отягощен за счет заболеваний желудочно-кишечного тракта у 30% (хронический гастрит, холецистит), хронических заболеваний верхних дыхательных путей (хронический тонзиллит, гайморит, хронический фарингит) у 32% женщин. Хронический цервицит был самым частым сопутствующим гинекологическим заболеванием (15%). Подавляющее большинство больных жаловались на нарушение менструального цикла и отсутствие беременности. Продолжительность менструального цикла колебалась от 28 до 46 дней, в среднем составила 34,4±4 дня. Только у 7 женщин (17,5%) в анамнезе были беременности и нарушение менструальной и репродуктивной функции появились позже.
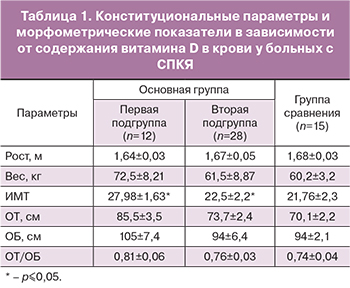
Анализ содержания витамина D в крови у больных основной группы выявил изменения во всех случаях. Однако степень снижения витамина D была различной. Были выявлены 12 женщин с выраженным дефицитом витамина D, средний уровень которого не превышал 11,49±2,1 нг/мл, они составили 1-ю подгруппу. Средний уровень витамина D у 28 женщин был достоверно выше, чем у пациенток 1-й подгруппы (21,8±3,58 нг/мл), но гораздо ниже нормальных значений (38,2±1,3 нг/мл). Эти пациентки были включены во 2-ю подгруппу. Мы провели сравнительную оценку двух подгрупп больных с разной степенью снижения витамина D. Оказалось, что в зависимости от содержания витамина D в крови женщины отличаются по телосложению, параметрам гормонального фона, метаболическим показателям.
Анализ данных, представленных в табл. 1, показал некоторые отличия между пациентками 1-й и 2-й подгрупп. Сравнительная оценка роста и веса у женщин обеих групп не выявила достоверной разницы. Тем не менее, оказалось, что женщины 1-й подгруппы имеют достоверно более высокий ИМТ (27,98±1,63) и тенденцию к увеличению соотношения ОТ/ОБ (0,81±0,06) по сравнению со здоровыми (ИМТ=21,76±2,3; ОТ/ОБ=0,74±0,04), тогда как у пациенток 2-й подгруппы эти показатели стремятся к нормальным значениям (22,5±2,2 и 0,76±0,03 соответственно). Это свидетельствует о значительном проявлении абдоминального ожирения у больных с выраженным дефицитом витамина D в крови. Связь дефицита витамина D в крови и ИМТ показана и в зарубежных исследованиях [10].
Кроме того, у больных первой группы были обнаружены существенные изменения параметров углеводного обмена (табл. 2).
Как следует из табл. 2, в ходе проведенного по международным стандартам орального глюкозотолерантного теста с 75 г сухой глюкозы достоверных отличий в содержании глюкозы в венозной плазме между группами не установлено. Однако именно в первой подгруппе обнаружены 2 женщины с признаками тяжелого нарушения толерантности к глюкозе (уровень глюкозы через 1 час достигал 13,2 ммоль/л), тогда как во второй подгруппе подобных изменений не было ни у одной больной.
Это свидетельствует о возможной зависимости развития инсулинорезистентности от содержания витамина D в крови у больных с СПКЯ. Именно в первой подгруппе установлена достоверно более значимая гиперинсулинемия. Уровень инсулина был в 2,44 раза выше у женщин с дефицитом витамина D, чем у пациенток 2-й подгруппы. Известно, что повышение уровня инсулина натощак может служить ориентировочным критерием инсулинорезистентности [11]. Кроме того, получена достоверная разница между группами по показателю индекса НОМА, который в первой подгруппе был в 2,6 раза выше, чем во второй. Описанные конституциональные и лабораторные изменения у больных с выраженным дефицитом витамина D в крови свидетельствуют о связи риска развития метаболического синдрома у больных с СПКЯ с дефицитом витамина D, причем чем ниже уровень 25 (OH) D3, тем более выраженные изменения наблюдаются. Подобная зависимость показателей углеводного обмена от количества витамина D в крови описана в литературе [12].
Кроме метаболических изменений у обследованных женщин были выявлены гормональные нарушения, характерные для СПКЯ. Несмотря на сходные клинические проявления и отсутствие достоверной разницы в продолжительности менструального цикла, был отмечен ряд достоверных отличий гормонального фона у больных с дефицитом витамина D (табл. 3).
Так, у больных 1-й подгруппы по сравнению с пациентками второй оказался повышенным индекс ЛГ/ФСГ – 1,83±0,86 против 1,03±0,27, тогда как у здоровых женщин этот показатель не превышал 0,81±0,12 и сопровождался регулярным менструальным циклом. Существенная разница была и в показателях андрогенов. Общий тестостерон в 1-й подгруппе почти в 2 раза (2,96±1,8 нмоль/л) превышал таковой во 2-й (1,5±0,9 нмоль/л), андростендион был в 1,7 раза выше в первой подгруппе по сравнению со второй (8,88±1,48нг/мл и 5,28±2,37 нг/мл соответственно). Снижение в 2 раза уровня ГСПГ в первой подгруппе (30,5±9,6 нмоль/л) по сравнению со второй (60,01±10,3 нмоль/л) и группой здоровых женщин (64,5±7,5) может быть закономерной причиной повышения андрогенов в крови и вполне вероятно зависит от содержания витамина D в крови у женщин.
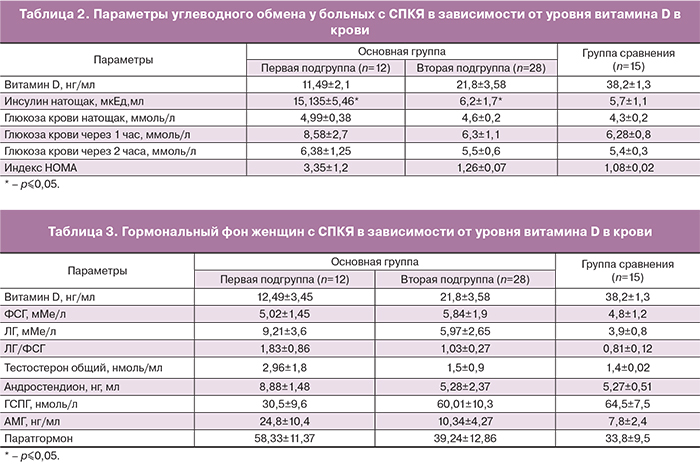
Биохимическая гиперандрогения нашла отражение в фенотипе СПКЯ – у женщин с очень низким уровнем витамина D преобладали фенотипы А, В, С по сравнению с пациентками с более высокими показателями 25 (OH) D3, у которых преимущественно установлен фенотип D. Известно, что первые три фенотипа характеризуются наличием клинических и лабораторных признаков гиперандрогении и более высокой оценкой по шкале Ферримана–Галвея. Согласно популяционному исследованию, проведенному академиком И.И. Дедовым, у 75% женщин с гирсутизмом и/или гиперандрогенией в сочетании с олиго/ановуляцией или без нее выявляется СПКЯ [13]. Данные современной литературы свидетельствуют о повышении уровня АМГ, как о важном признаке СПКЯ [14, 15]. Содержание АМГ было высоким у всех пациенток, но существенное увеличение его значений наблюдалось именно у женщин с очень низким содержанием 25 (OH) D3 – 24,8±10,4 нг/мл, что примерно в 3 раза выше показателя здоровых женщин без СПКЯ (7,8±2,4 нг/мл). Во второй группе уровень АМГ был выше лишь в 1,3 раза (10,34 ±3,6 нг/мл). Это свидетельствует о возможном влиянии витамина D на функцию яичников.
Интересен тот факт, что продолжительная гиперандрогенемия в целом и повышение концентрации тестостерона в крови в частности приводят к гиперкальциемии за счет выхода кальция из костных депо. Этот процесс регулируется гормоном С-клеток щитовидных желез кальцитонином, который повышается в ответ на введение экзогенного тестостерона, а также паратгормоном, который повышает уровень кальция в крови. Кальций поступает в клетки по градиенту концентрации, что на фоне гиперкальциемии может приводить к избыточному накоплению ионов кальция внутри клетки и способствовать повреждению клеток [16]. Как известно, концентрация кальция в сыворотке крови регулируется с высокой точностью и меняется в очень узких пределах [17]. Закономерно, что в нашем исследовании у больных с очень низким содержанием витамина D и выраженной клинико-лабораторной гиперандрогенией паратгормон был выше в 1,5 раза, чем у женщин второй группы и группы сравнения, что можно объяснить компенсаторной реакцией организма на снижение всасывания кальция на фоне нехватки витамина D и запуском механизма регуляции константного содержания кальция в крови человека.
Учитывая полученные результаты (снижение уровня витамина D у всех больных с СПКЯ, изменение гормонального фона, метаболические нарушения) и данные литературы о возможности применения витамина D в больших дозах для восстановления репродуктивной функции, мы включили в схему лечения СПКЯ витамин D. Все пациентки получали препарат аквадетрим по 12 кап (6000 МЕ витамина D) один раз в день в течение 3 месяцев, после чего было проведено повторное исследование. Оказалось, что постоянный прием большой дозы витамина D в течение трех месяцев приводил к восстановлению нормальных уровней 25 (OH) D3 в крови только у пациенток второй группы с умеренным снижением витамина D. У больных с тяжелым дефицитом витамина D наблюдалась лишь тенденция к нормализации показателей и требовался более продолжительный прием препарата. Тем не менее, изменение содержания витамина D в крови привело к снижению уровня андростендиона, АМГ и повышению ГСПГ уже к концу третьего месяца терапии. Наблюдалась тенденция к нормализации соотношения гонадотропных гормонов (ЛГ/ФСГ) и показателей глюкозотолерантного теста с одновременным снижением уровня инсулина в крови, что нашло отражение в изменении антропометрических показателей – уменьшение ОТ и ИМТ. Женщины отмечали укорочение межменструальных промежутков и восстановление менструального цикла. У одной пациентки наступила спонтанная беременность.
Выводы
- Содержание витамина D в крови снижено у всех больных с СПКЯ, причем выраженный дефицит наблюдается у женщин с гиперандрогенными фенотипами СПКЯ, недостаток витамина D – у женщин без гиперандрогенемии.
- Дефицит витамина D у больных с СПКЯ сопровождается изменениями гормонального фона: повышением соотношения гонадотропных гормонов (ЛГ/ФСГ>1,0), андростендиона, АМГ и снижением ГСПГ, что, в свою очередь, находит отражение в клинических проявлениях заболевания.
- Выраженное снижение витамина D приводит к развитию симптомов метаболического синдрома (висцерального ожирения, гиперинсулинемии, инсулинорезистентности), что усугубляет нарушения репродуктивной функции у больных с СПКЯ.
- Таким образом, содержание витамина D в крови у больных с СПКЯ играет определенную роль в развитии симптомов нарушения менструальной функции, проявлений гиперандрогении и фенотипа заболевания. Возможности использования витамина D в лечении СПКЯ, подбор оптимальной дозы, а также продолжительности терапии требуют дальнейшего изучения.



