В России, как и в других странах Восточной Европы, неуклонно регистрируются высокие уровни заболеваемости раком шейки матки (РШМ) и смертности от этого заболевания. В 2013 г. было зарегистрировано 15 427 впервые заболевших РШМ, погибло 6522 пациенток. Удельный вес запущенных стадий составил 35,9%, показатель одногодичной летальности – 16,5%. В общей структуре онкологической заболеваемости РШМ составляет 5,3%, занимая 6-е место, а среди органов репродуктивной системы – 3-е (14%) после рака молочной железы (54,5%) и эндометрия (19,3%). В течение последнего десятилетия отмечается постепенный рост заболеваемости РШМ: среднегодовой прирост составляет 2,2%, общий – 25,2% [1].
В то же время, как показывают исследования, распространенность вируса папилломы человека (ВПЧ) в популяции российских женщин не отличается от других европейских стран, где заболеваемость РШМ значительно ниже [2].
Почему же в нашей стране сложилась такая ситуация? Скорее всего, ее можно объяснить недостаточными мерами профилактики, а именно отсутствием централизованной программы скрининга и ограниченной эффективностью оппортунистических (спорадических) скрининговых мероприятий.
В нескольких европейских странах созданы и функционируют государственные программы централизованного скрининга, которые привели к существенному, документально подтвержденному снижению заболеваемости РШМ и летальности от него. Очевидно, что эффективность скрининга зависит от постоянных государственных вложений, равно как и от взаимодействия между системой здравоохранения и населением. Доказано, что иные подходы менее эффективны в силу недостаточности систематического контроля полноты охвата населения, качества скрининга (соблюдения протоколов) и последующего наблюдения.
Цель исследования: определить современные наиболее эффективные направления профилактики РШМ.
Методы профилактики РШМ и организация профилактических мероприятий в России
Наиболее эффективные методы профилактики появились вскоре после идентификации ВПЧ как основного причинного фактора практически всех случаев РШМ.
Первичная профилактика РШМ включает выявление и устранение или ослабление неблагоприятных факторов, влияющих на возникновение злокачественной опухоли, прежде всего путем устранения или минимизации контакта с канцерогеном [3]. Достичь этого можно путем санитарно-просветительской работы и повышения осведомленности населения об инфекциях, передаваемых половым путем, и их осложнениях, пропаганды здорового образа жизни (воздержание от внебрачных половых связей, ограничение числа половых партнеров, использование презервативов и сохранение репродуктивного здоровья) [4].
Методом специфической первичной профилактики РШМ является вакцинация от ВПЧ [5]. В России в настоящее время зарегистрированы две профилактические вакцины: квадривалентная вакцина гардасил и бивалентная вакцина церварикс [6].
В Москве с 2009 г. приказом Департамента здравоохранения и Роспотребнадзора вакцинопрофилактика РШМ включена в региональный календарь профилактических прививок. За 2,5 года вакцинировано 2500 девочек, достигших 13-летнего возраста. В 9 регионах Московской области благодаря областной программе «Вакцинопрофилактика онкологических заболеваний, вызываемых вирусом папилломы человека» (2007–2010 гг.) за период с 2008 по 2010 г. привиты 6850 девочек в возрасте 12–13 лет. С 2012 г. планируется привить 3000 девочек в возрасте 12–13 лет [7].
В настоящее время ведутся поиски создания терапевтической вакцины против ВПЧ. В университете Лейдена (Голландия) продолжается экспериментальное исследование вакцины, созданной специально для лечения женщин с уже развившимися предраковыми заболеваниями гениталий [8].
Вторичная профилактика РШМ направлена на выявление и устранение предраковых заболеваний и выявление злокачественных опухолей на ранних стадиях процесса, что достигается путем скрининга, охватывающего не менее 80% популяции. РШМ является одной из нозологических форм, удовлетворяющих всем требованиям популяционного скрининга: заболевание является проблемой здравоохранения; имеет длительный период развития от преинвазивной стадии до инвазивного рака (до 10 лет); надежно распознается в преклинической фазе; подвергается эффективным методам лечения; обладает высокоэффективным цитологическим скрининг-тестом [9].
Ввиду огромных размеров популяции и стоимости мероприятия исследование должно приносить реальную пользу, обычно выражаемую в высоких показателях выживаемости населения [3]. С учетом длительного развития РШМ (8–10 лет) проведение скрининга позволяет снизить смертность от РШМ на 70% [10].
Методы скрининга и их эффективность. В настоящее время диагностической доктриной раннего выявления РШМ является широкий охват цитологическим скринингом женского населения (75–90%). Доказано, что цитологический метод исследования является весьма чувствительным в диагностике цервикальных интраэпителиальных неоплазий (CIN), карциномы in situ, микроинвазивного и скрытого инвазивного рака [10].
Результатом, подтверждающим эффективность такого режима скрининга, является снижение показателей заболеваемости и смертности от РШМ в развитых странах. За последние 50 лет обследование на три четверти снизило заболеваемость РШМ в мировом масштабе; в Исландии, где общенациональные программы по скринингу охватили почти 100% населения, за 20 лет смертность от РШМ снизилась на 80% [11, 12].
Сегодня используются три морфологические классификации цервикальных мазков: по Папаниколау (Пап-тест, Pap-smear, Pap-мазок), ВОЗ и Bethesda System [2]. Чувствительность цитологического исследования по данным различных публикаций составляет от 66 до 83% [13]. В 70–90% случаев причиной ложноотрицательных цитологических ответов является плохой забор материала для цитологического исследования, в 10–30% – ошибочная интерпретация цитологических данных. Считается, что до 30% случаев РШМ развивается у женщин, которые регулярно проходили цитологический скрининг, то есть давали ложноотрицательные результаты, которые регистрируются даже в лучших скрининговых программах [14].
Все эти аргументы послужили основой для поиска новых скрининговых технологий, среди которых предлагаются автоматизированные системы жидкостного цитологического анализа, обеспечивающие достаточную точность результатов скрининга и высокую производительность [2].
Следует отметить, что из-за длительного периода развития РШМ частота проведения раундов цитологического скрининга имеет значительно меньшее влияние на его эффективность по сравнению с широтой охвата.
Информативность цитологического метода при CIN и ранних формах РШМ варьирует от 50 до 87%. По данным зарубежных авторов, у 24–32% женщин выявляли инвазивный РШМ при нормальном цитологическом результате ПАП-теста [15]. Поэтому важность обследования другими методами исследования очевидна.
Подтверждение этиологической роли ВПЧ в развитии РШМ привело к тому, что тестирование на ВПЧ ввиду его гораздо более высокой чувствительности по сравнению с цитологическим исследованием стало рассматриваться как важнейший элемент скрининга этого заболевания [16].
Международными экспертными организациями были сформулированы следующие рекомендации по применению ВПЧ-теста в скрининге РШМ: в первичном скрининге у женщин старше 30 лет в сочетании с цитологическим исследованием или в качестве самостоятельного теста; при ведении пациенток с неопределенными результатами цитологического исследования; для мониторинга терапии цервикальных поражений высокой степени [17].
В опубликованных за последние годы исследованиях продемонстрировано, что определение ВПЧ методом полимеразной цепной реакции (ПЦР) обладает большей чувствительностью по сравнению с цитологическим исследованием при прогнозе онкологической патологии шейки матки [18–20].
Чувствительность скрининга на ВПЧ по выявлению онкопатологии шейки матки составляет около 95%, в то время как чувствительность цитологического скрининга составляет не более 80% [21]. Кроме того, в настоящее время предложены тест-системы для самостоятельного забора материала женщинами в домашних условиях, а автоматизация проведения исследований обеспечивает высокую пропускную способность, следствием чего являются меньшие экономические затраты [22–24]. Лица с положительным результатом тестирования рассматриваются как имеющие патологию или потенциальный риск ее развития [22].
Совместное применение теста для идентификации ВПЧ и ПАП-теста в зарубежных странах позволило повысить чувствительность выявления СIN до 99–100% и увеличить интервалы между исследованиями до 5–7 лет [25].
Выделяют две системы скрининга РШМ: организованный (систематический) скрининг и неорганизованный (спорадический) скрининг. В первом случае определяются группы женщин, подлежащих скринингу, которые активно приглашаются принять участие в обследовании. Во втором случае обследуются лишь женщины, которые обратились в лечебно-профилактические учреждения по каких-либо причинам. Эффективность организованного скрининга выше, чем неорганизованного.
Также одним из важнейших методов диагностики заболеваний вульвы, влагалища и шейки матки является кольпоскопическое исследование. Обзор шейки матки под большим увеличением позволяет с высокой степенью точности дифференцировать доброкачественные изменения от раковых, но требует специальной подготовки специалистов и дополнительного оборудования, поэтому не может использоваться в скрининге как основной.
Скрининг в России и перспективы повышения его эффективности
В нашей стране цитологический метод исследования при массовых профилактических гинекологических осмотрах стали применять с 1964 г., а с 1977 г. на основании приказа Минздрава СССР № 1253 от 30.12.1976 г. была создана сеть централизованных цитологических лабораторий (ЦДЛ). Однако эта практика была утрачена, и за последние более чем 20 лет наблюдается прирост заболеваемости РШМ в России: с 12,4 на 100 тыс. женского населения в 1989 г. до 20,0 на 100 тыс. женского населения в 2013 г. Не отмечается и статистически достоверное снижение удельного веса больных с запущенными стадиями заболевания РШМ.
В настоящее время общегосударственных программ скрининга РШМ в России нет. Степень охвата населения профилактическими осмотрами на сегодняшний день невысокая, хотя с 2013 г. начался новый этап диспансеризации населения страны, в которую включены мероприятия по выявлению патологии шейки матки.
Приказами Министерства здравоохранения регламентированы лишь общие положения о целесообразности ежегодных профилактических осмотров женщин, начиная с 18 лет и старше, с цитологическим исследованием мазков с экто- и эндоцервикса. Фактически в России проводится «оппортунистический скрининг», в котором участвует не более 30% женского населения, а межскрининговый интервал варьирует от 1 до 5 лет [26]. В нашей стране усилия сконцентрированы почти исключительно на повышении эффективности лечения, однако очевидна настоятельная необходимость изменения стратегии в сторону интеграции региональных противораковых программ, разработанных на основе современных представлений о канцерогенезе, факторах риска, методах диагностики и лечения. И если сегодня не проводить активный скрининг РШМ по всей территории России, то рассчитывать на снижение заболеваемости РШМ в ближайшие годы не приходится.
Ведение женщин с положительными результатами скрининга
В многочисленных руководствах рекомендуется лечение, направленное на макроскопические (например, остроконечные кондиломы) или патологические предраковые поражения, вызванные ВПЧ. Субклиническая генитальная инфекция ВПЧ, как принято считать, обычно спонтанно элиминируется, поэтому специфическая противовирусная терапия не проводится.
Выбор тактики лечения ВПЧ-ассоциированных заболеваний базируется на установленном диагнозе, особенностях морфологической характеристики очага, локализации и размера поражения, предпочтениях пациентки и ее репродуктивных планах, а также наличия сопутствующей патологии. В связи с вышесказанным терапия направлена либо на разрушение тем или иным способом папилломатозных очагов, либо на активацию противовирусного иммунного ответа, либо на сочетание обоих подходов. Кроме того, в схемы терапии папилломавирусной инфекции (ПВИ) могут быть включены антисептики, антибактериальные и противовирусные препараты для ликвидации воспалительного процесса шейки матки и влагалища; гормональные препараты – при сопутствующих нарушениях функции яичников.
Предложено большое число методов лечения аномально измененного эпителия шейки матки, а также влагалища и вульвы, однако ни один из них не является универсальным; остается вероятность развития рецидивов, частота которых составляет в среднем 25–30% в течение 3 месяцев после лечения [27–29]. Кроме того, на рецидивирование ПВИ влияет состояние иммунной системы – показано, например, что у ВИЧ-инфицированных пациентов рецидивы возникают гораздо чаще и с большей площадью поражений [30].
В целом, при лечении рецидивирующей ПВИ отмечается низкая эффективность применения только деструктивных методов лечения в связи с неполным устранением генома ВПЧ из очагов поражений, а также из соседних участков кожи. Поэтому комплексное лечение таких больных намного результативнее.
Таким образом, адекватным является проведение комплексного лечения, включающего не только воздействие на патологически измененные ткани, но и неспецифическую противовирусную и иммуномодулирующую терапию.
Применение иммуномодуляторов в комплексной терапии ПВИ и их эффективность
Учитывая, что в основе любого хронического инфекционно-воспалительного процесса лежат различные патологические изменения в иммунной системе, альтернативным средством терапии может быть локальное и/или системное применение иммуномодуляторов, особенно при обширных поражениях и/или рецидивирующих процессах, так как эти препараты стимулируют неспецифический иммунитет, усиливают продукцию интерлейкинов [31–33].
Кроме того, на стадии заболевания, когда имеются субклинические формы и минимальные изменения эпителия (легкая дисплазия или атипические изменения неясной причины), связанные с ВПЧ, вирус еще находится в клетке в эписомальном состоянии и не повреждает ее геном. Следовательно, именно на этом этапе развития системный и местный иммунитет будет играть ведущую роль в элиминации этиологического агента и прогнозе развития болезни.
По данным биопсий шейки матки латентные формы инфекции выявляются у 8,1% женщин, а субклинические – у 40–60% [34]. Именно поэтому медикаментозная терапия при начальных формах поражения эпителия должна быть направлена на подавление вируса при соблюдении комплаенса, понимании пациенткой необходимости завершения курса для повышения эффективности лечения.
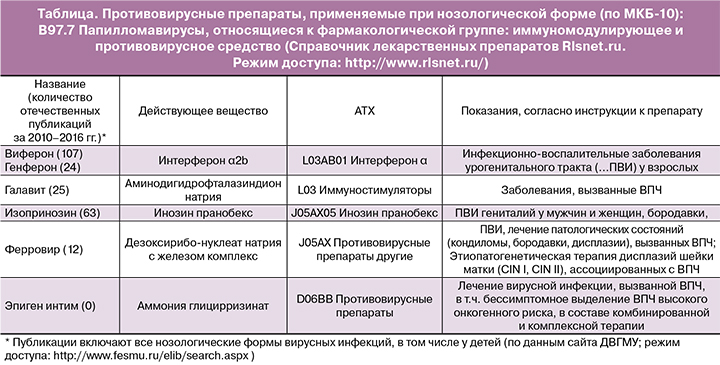
В исследовании R. Richard и B. Barron [35] было показано, что среднее время для развития карциномы in situ составляет примерно 5 лет для больных со слабой дисплазией, 3 года – с умеренной и 1 год – с выраженной дисплазией. Это позволило предположить, что 66% всех дисплазий будет прогрессировать до карциномы, но достаточно длительное время, которое необходимо использовать для раннего выявления и лечения. Несмотря на то что имеется достаточный период безопасного времени для динамического наблюдения, вопрос лечения ставится сразу после установления диагноза, что определяет активную тактику ведения больных, включая деструкцию активной зоны трансформации и иммуно/противовирусную терапию. При этом в справочнике РЛС перечень препаратов, имеющих показание для применения «папилломавирусная инфекция», оказался весьма узок (таблица).
Анализ публикаций, выполненных на основе оригинальных исследований по лечению ПВИ у женщин, показал наибольшее их количество по препарату инозин пранобекс.
Инозин пранобекс – это иммуномодулятор, стимулирующий противовирусную защиту организма – один из немногих иммунотропных и противовирусных препаратов, в инструкции по применению которого указана терапия заболеваний, вызванных ВПЧ [36]. В настоящее время накоплен огромный опыт применения изопринозина, так как используется он с 1970-х гг. и зарегистрирован в большинстве стран Европы. Он входит в Европейскую классификацию методов лечения аногенитальных бородавок и кондилом [37], в российский протокол ведения больных с ПВИ шейки матки высокого онкогенного риска [38]. В ассоциированной ВОЗ международной анатомо-терапевтическо-химической классификации лекарственных препаратов (АТХ) инозин пранобекс зарегистрирован в группе антивирусных препаратов для системного использования (J05AX05).
Изопринозин восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитарных клеток, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, предупреждает снижение активности лимфоцитарных клеток под влиянием глюкокортикоидов, нормализует включение в них тимидина. Изопринозин оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию IgG, интерферона γ, интерлейкинов (ИЛ)-1 и ИЛ-2, снижает образование провоспалительных цитокинов – ИЛ-4 и ИЛ-10, потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов [36].
Помимо иммунотропного, изопринозин обладает прямым противовирусным действием, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной РНК [36].
Таким образом, обладая противовирусным действием и оказывая влияние на противовирусный иммунитет, изопринозин прямо и косвенно способен подавлять репликацию ВПЧ и образование вирусных белков. Эти эффекты могут изменять механизм взаимодействия ВПЧ и макроорганизма, препятствуя переходу вируса из транзиторной в персистирующую форму, а также влияя на клиническую манифестацию инфекции.
В инструкции описаны различные схемы применения изопринозина: при ПВИ его назначают по 3 г/сут (2 таблетки 3 раза в сутки) в течение 14–28 дней; при дисплазии шейки матки, ассоциированной с ВПЧ, изопринозин применяют по 2 таблетки (1 г) 3 раза в сутки в течение 10 дней, далее 2–3 курса с интервалом 10–14 дней.
В 2009 г. был опубликован систематический обзор литературы и мета-анализ применения инозина пранобекса, выполненный М.Ю. Елисеевой и О.А. Мынбаевым [33], в который вошли и результаты программы «Астра» — общероссийской многоцентровой программы мониторинга, обобщения и формирования статистической отчетности об особенностях и результатах применения изопринозина при лечении заболеваний, ассоциированных с ВПЧ, в условиях обычной медицинской практики с участием 6191 пациентов.
Анализ свидетельствует о том, что степень эффективности плацебо составляет 27,9% (95% ДИ: 16,3–39,4), а традиционных методов лечения – 59,1% (95% ДИ: 57,0–61,0). Эффективность инозина пранобекса в большинстве работ оценена в зависимости от режима его применения. При этом в 63,5% случаев с 95% ДИ (57,0–70,0) отмечено клинико-лабораторное улучшение после применения инозина пранобекса в монорежиме, что заметно контрастирует с более высокими результатами комбинированного применения инозина пранобекса – 90,7% (86,9–94,5).
Результаты программы Астра отличаются также высокой эффективностью, соответствующей аналогичным данным комбинированного применения инозина пранобекса. Так, общая эффективность применения изопринозина составила 89,5% (95% ДИ: 89,3–89,7).
При этом некоторые авторы приводят данные о прекращении выделения вируса после проведенного комбинированного лечения с применением инозина пранобекса от 65,6 до 95,3% [39–41] (против 46,9% – без использования инозина пранобекса) [41].
Есть и другие исследования, в которых показано прекращение выделения ВПЧ из очагов поражения у 69,6–97,8% женщин, принимавших изопринозин [42–44].
Поиск работ, выполненных за последние 5 лет (после 2010 года), демонстрирует продолжающийся интерес исследователей к изучению инозина пранобекса в лечении заболеваний, вызванных ВПЧ [28, 31, 32, 45–50].
Наиболее крупное исследование, выполненное в 2012 году, представляет собой сравнительный анализ результатов лечения 5650 больных с ВПЧ-ассоциированными заболеваниями, представленных 352 врачами из 33 городов России, по стандартизированной балльной системе оценки основных клинико-лабораторных параметров (жалобы, визуальные проявления болезни, ДНК ВПЧ тест и побочные эффекты) до и после применения изопринозина в моно- и комбинированном режиме. Спонтанная элиминация ВПЧ обнаружена в 22,6% случаев при повторном анализе спустя 6 месяцев у нелеченных женщин; после традиционных методов лечения ВПЧ тесты оказались негативными в 35,5%, тогда как после применения изопринозина в монорежиме прекращение выделения вируса достигнуто в 54,8%, при комбинированном – в 84,2% наблюдений. Отмечено также существенное снижение жалоб и размеров остаточных явлений визуальных изменений после комбинированного применения изопринозина по сравнению с аналогичными показателями, при применении как традиционных методов лечения, так и изопринозина в монорежиме [47].
На наш взгляд, наиболее интересными являются те работы, которые изучают возможности элиминации ВПЧ на самых ранних стадиях процесса. Так, А.Г. Кедрова с соавт. [48] изучили эффективность и переносимость препарата инозин пранобекс для лечения ВПЧ-ассоциированных начальных изменений эпителия шейки матки в различных режимах в сравнительном аспекте между собой и группой контроля. Обследованы 128 пациенток репродуктивного возраста, имеющие цитологические признаки легкой дисплазии шейки матки и/или кольпоскопические изменения эпителия. Пациентки 1-й группы (n=48) получали инозин пранобекс 28 дней; 2-й группы (n=41) – 14 дней, контрольная группа (n=39) – без медикаментозного лечения. Показаны преимущества активной тактики ведения пациенток при выявлении ВПЧ-ассоциированных повреждений эпителия шейки матки неясного генеза или низкой степени (LSIL, ASCUS). Шестимесячное наблюдение за такими женщинами продемонстрировало высокую скорость элиминации вируса после применения инозин пранобекса (93,7% при 28-дневном курсе, 78% – при 14-дневном и лишь 43% – без лечения). При этом получены лучшие результаты после 28-дневного режима лечения при хорошей переносимости препарата.
С.А. Гаспарян с соавт. [49] в поиске оптимизации лечения ВПЧ-ассоциированных начальных поражений шейки матки провели сравнение результатов лечения с использованием однократного 28-дневного курса инозин пранобекса с трехкратным курсом лечения по 14 дней.
В исследовании приняли участие 64 больных в возрасте 20–40 лет, инфицированные ВПЧ высокого канцерогенного типа и имеющие цитологические признаки ПВИ или плоскоклеточного поражения легкой степени (LSIL) и/или кольпоскопические изменения эпителия, соответствующие низкоатипическим. Больные были разделены на три группы в зависимости от тактики ведения: 1-я группа (n=26) получала инозин пранобекс трехкратным курсом по 14 дней с 10-дневными интервалами; 2-я группа (n=20) получала изопринозин 28 дней; 3-я группа (n=18), контрольная, не получала какого-либо лечения. Оценка эффективности лечения проводилась через 6 месяцев путем ПЦР-диагностики, цитологического исследования и кольпоскопии. Инозин пранобекс продемонстрировал высокую эффективность в лечении таких заболеваний, при этом наилучшие результаты достигнуты при его применении трехкратным курсом по 14 дней с 10-дневными интервалами.
Это объясняется тем, что наиболее опасной с точки зрения прогрессирования дисплазии является персистенция ВПЧ, при которой вирус встраивается в геном эпителиальной клетки. Противовирусное действие при этом должно продолжаться несколько месяцев, чтобы захватить несколько циклов полного обновления эпителия. Именно поэтому для консервативной терапии дисплазий предлагается длительное многокурсовое лечение — два-три 10-дневных курса с интервалом 10–14 дней.
Таким образом, у пациенток с «минимальным» повреждением эпителия шейки матки, например ASCUS, с наличием цитоплазматического эффекта ВПЧ (койлоцитоз при цитологическом исследовании) и положительном ВПЧ-тесте может оказаться актуальным применение препарата с двойным противовирусным действием — инозин пранобекс (изопринозин), когда местные деструктивные воздействия еще не показаны.
В связи с лучшими результатами при более продолжительном курсе лечения обсуждаются вопросы комплаентности назначенного врачом лечения. На примере проведенного двухэтапного исследования пациентов с ПВИ демонстрируются возможности повышения эффективности проводимой терапии при введении компонента мотивации как стимулятора соблюдения пациентками режима и схемы лечения. Так, в группе пациенток, с которыми была проведена беседа, 100% комплаенс был в 87,4% случаев, а среди тех, с кем такая беседа проведена не была – только в 42,8% [50].
Представленные данные свидетельствуют о возможной эффективности монотерапии изопринозином при бессимптомном вирусовыделении.
Заключение
Таким образом, основными профилактическими мероприятиями, направленными на раннее выявление и преодоление прогрессирования ВПЧ-ассоциированной патологии шейки матки, являются: организованный скрининг (определение ВПЧ); раннее лечение предраковых заболеваний и противовирусная терапия изопринозином, в том числе при начальных изменениях эпителия шейки матки или бессимптомном вирусоносительстве, направленная на нормализацию цитологической картины и подавление вирусной активности.
Для достижения положительных результатов важным является соблюдение режима лечения в соответствие с предписаниями врача в отношении дозы, кратности приема препарата и продолжительности курса.



