В структуре причин репродуктивных потерь, неонатальной смертности и детской инвалидности одно из ведущих мест занимают хромосомные анеуплоидии. Они обуславливают не менее 30% спорадических неразвивающихся беременностей и выкидышей, а у новорожденных встречаются с частотой до 1:300. Наиболее частыми являются трисомии по 21, 18 и 13-й хромосомам. Применяемый в настоящее время комбинированный скрининг беременных, позволяющий сформировать группу высокого риска по хромосомной патологии для последующего проведения инвазивной пренатальной диагностики, основывается на данных УЗИ и определении материнских сывороточных маркеров. Наиболее эффективным методом считается оценка сочетания возраста матери, толщины воротникового пространства (измеренного при экспертном УЗИ) и биохимического исследования крови матери на содержание свободной β-субъединицы хорионического гонадотропина человека (β-ХГЧ) и плазменного протеина А (PAPP-A) при сроках беременности 11–14 недель с последующим программным комплексным расчетом индивидуального риска рождения ребенка с хромосомной патологией. Однако данный скрининг позволяет отнести в группу высокого риска по хромосомной патологии лишь около 80% беременностей плодами с трисомией по 21-й хромосоме и сопровождается значительным количеством ложноположительных результатов [1]. Поэтому имеется необходимость в разработке и внедрении в практическое здравоохранение более современных неинвазивных скрининговых методов, позволяющих выделять группу риска с более высокой точностью.
Наиболее перспективным в данном направлении является неинвазивный пренатальный метод скрининга анеуплоидий, основанный на анализе внеклеточной ДНК плода в крови матери (ДНК-скрининг). ДНК-скрининг может проводиться с использованием технологии высокопроизводительного секвенирования с последующим статистическим биоинформационным анализом. В большинстве случаев ДНК плода циркулирует в крови матери в достаточном для анализа количестве (более 4–5%) начиная с 10–11 недель беременности и не детектируется уже через сутки после родов. Это позволяет осуществлять ДНК-скрининг, в том числе у повторно беременных женщин. Неинвазивный пренатальный ДНК-скрининг анеуплоидий плода по крови матери, в отличие от применяемых в настоящее время методов скрининга, является прямым методом исследования и потенциально может служить эффективным инструментом выявления хромосомных анеуплоидий плода у беременных женщин.
Целью исследования являлась оценка эффективности использования неинвазивного пренатального ДНК-скрининга анеуплоидий плода по крови матери в клинической практике.
Материал и методы исследования
Впервые в России оценка эффективности использования данной медицинской технологии для диагностики анеуплоидий плода в группе беременных высокого риска описана в работе Г.Т. Сухих и соавт. [2]. К настоящему времени в ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России с помощью технологии неинвазивного ДНК-скрининга по крови матери обследовано 259 женщин группы высокого риска (выборка 1), направленных на пренатальную инвазивную диагностику с целью проведения кариотипирования плода.
Все беременные имели высокий риск хромосомной патологии плода, обусловленный возрастом, изменениями в уровнях сывороточных маркеров, особенностями фенотипа плода.
Забор крови для ДНК-скрининга осуществлялся на сроке беременности 10–20 недель (медиана составила 14 недель). Обследование также включало: скрининг I–II триместров беременности – УЗИ, определение материнских сывороточных маркеров, компьютерный анализ, а также инвазивные процедуры с последующим кариотипированием. Внутриматочные вмешательства с целью получения хориона, плаценты, амниотической жидкости выполняли в 11–14 недель или в 17–20 недель в связи с противопоказаниями к проведению в ранние сроки беременности или поздним обращением женщины. У всех женщин было получено согласие на инвазивную пренатальную диагностику (биопсия ворсин хориона, плаценты, амниоцентез) и забор крови из вены для ДНК-скрининга. Перед проведением инвазивной пренатальной диагностики у женщин из периферической вены аспирировали 10,0 мл крови.
ДНК-скрининг анеуплоидий плода по крови матери проводили следующим образом. На первом этапе из крови женщины выделяли плазму. На втором этапе выделяли внеклеточную ДНК, содержащую материнскую и плодовую фракции. В последующем последовательно осуществляли приготовление библиотек ДНК для полупроводникового секвенирования, эмульсионную ПЦР и высокопроизводительное секвенирование (NGS) на приборе IonProton (LifeTechnologies ThermoFisher, США). Результаты оценивали с помощью биоинформатической обработки данных секвенирования ДНК. Достаточным считали содержание плодовой ДНК не менее 4%.
Оценку эффективности использования данной медицинской технологии для диагностики основных трисомий плода в смешанной группе беременных (выборка 2) проводили в рамках совместных исследований с МГУ им. М.В. Ломоносова. Было обследовано 270 женщин, из которых 93 имели высокий риск, обусловленный возрастом беременной, изменениями в уровнях сывороточных маркеров, особенностями фенотипа плода и 177 женщин с низким риском хромосомной патологии у плода.
У всех женщин было получено информированное согласие на забор крови из вены для использования их образцов в научно-исследовательской работе. Медиана возраста женщин на момент беременности составляла 35,1 года, мода 37,5 года. Женщины проходили стандартное обследование, которое включало: скрининг I–II триместра беременности – УЗИ, определение содержания сывороточных маркеров, компьютерный анализ. При высоком риске производилась инвазивная пренатальная диагностика с проведением кариотипирования.
ДНК-скрининг анеуплоидий плода по крови матери проводили следующим образом. На первом этапе из крови женщины выделяли плазму, на втором – внеклеточную ДНК, содержащую материнскую и плодовую фракции. В последующем осуществляли приготовление библиотек ДНК для высокопроизводительного (NGS) секвенирования на приборе HiSeq 1500 (Illumina, США). Данные секвенирования обрабатывали с использованием оригинального биоинформатического программного обеспечения. Достаточным считали содержание плодовой ДНК не менее 5%.
Оценку достоверности полученных результатов проводили путем сравнения с данными о кариотипе плода и исходах беременностей. Цитогенетическое исследование тканей плодового происхождения проводили у 93 беременных с высоким риском наличия хромосомной патологии плода. У 177 женщин с низким риском беременность закончилась родами и было получено фенотипическое подтверждение отсутствия анеуплоидий.
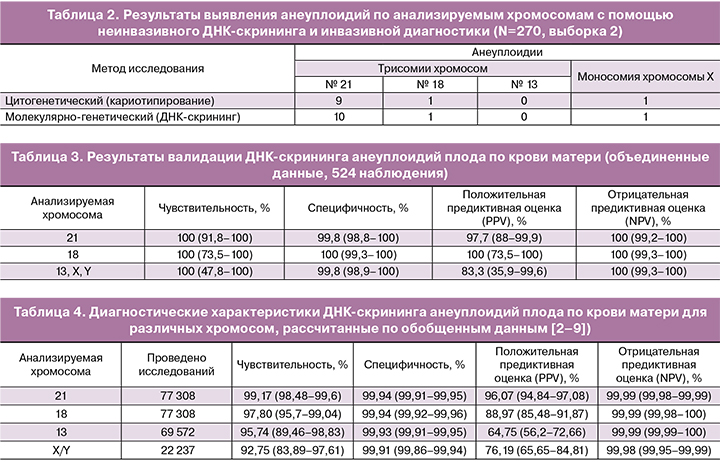
Помимо этого, проведен сравнительный анализ полученных в ходе исследования результатов с обобщенными литературными данными, включающими 77 308 исследований беременных с помощью неинвазивного ДНК-скрининга на наличие анеуплоидий по 21-й и 18-й хромосомам, 69 572 исследования анеуплоидий хромосомы 13 и 22 237 исследований половых хромосом [3–10].
95% доверительные интервалы для чувствительности, специфичности и положительной (PPV) и отрицательной (NPV) предиктивных оценок рассчитывались на основании распределения χ2 [11].
Результаты исследования
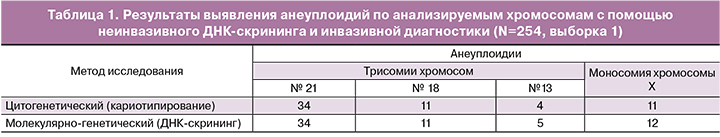
Во всех 259 наблюдениях женщин высокой группы риска (выборка 1) был определен кариотип плода с помощью стандартного цитогенетического исследования тканей плодового происхождения (хорион, плацента, амниотическая жидкость), при этом периферическая кровь женщин была исследована на наличие анеуплоидий у плода методом высокопроизводительного секвенирования (неинвазивный пренатальный ДНК-скрининг по крови матери). У 197 плодов по данным инвазивной диагностики установлен нормальный хромосомный набор, у 62 – патологический. Патология кариотипа была представлена: 34 наблюдения с трисомией по 21-й хромосоме, 11 наблюдений с трисомией по 18-й хромосоме, 5 наблюдений с трисомией по 13-й хромосоме, 12 наблюдений с моносомией хромосомы Х.
Среднее содержание плодовой ДНК в образцах составило 11,6%. В пяти образцах уровень плодовой ДНК был менее 4,0%, в связи с чем они были исключены из дальнейших расчетов диагностических характеристик ДНК-скрининга. Важно отметить, что в двух образцах с низкой долей плодовой ДНК молекулярно-генетическим методом не были выявлены трисомии по 21 хромосоме, что подтвердило важность оценки доли плодовой ДНК для подтверждения валидности результатов ДНК-скрининга. Результаты выявления анеуплоидий для тех образцов, где доля плодовой ДНК была не менее 4%, представлены в табл. 1. Всего в анализ включено 254 образца.
Сопоставление полученных обоими методами результатов показало, что в 252 из 254 (99%) случаях данные цитогенетического и молекулярно-генетического исследований были идентичны. Всего молекулярно-генетическим методом было выявлено 62 анеуплоидии по 21, 18, 13-й и половым хромосомам, из них трисомия по 21-й хромосоме – 34 наблюдения, трисомия по 18-й хромосоме – 11 наблюдений, трисомия по 13-й хромосоме – 5 наблюдений. Получен один ложноположительный результат при выявлении трисомии по хромосоме 13 и один ложноположительный результат по X-хромосоме.
При анализе половых хромосом все клинические образцы, где определялась Y-хромосома, были отнесены к мужскому полу, все отрицательные по Y-хромосоме образцы рассматривались как относящиеся к женскому полу. Моносомия хромосомы Х была определена в 12 наблюдениях и подтверждена данными кариотипирования в 11. В одном случае был получен результат, трактуемый как моносомия хромосомы X при наличии у плода нормального женского кариотипа 46,ХХ. Таким образом, чувствительность определения половых хромосом составила 100% (71,51–100%), специфичность – 99,59% (97,73–99,99%), что свидетельствует о возможности определения пола плода и моносомии по Х-хромосоме.
В данном исследовании чаще всего наблюдали анеуплоидии по 21, 18-й и половым хромосомам, тогда как трисомии по 13-й хромосоме в обследованной выборке присутствовали в небольшом количестве. При выявлении моносомии хромосомы X и трисомии по 13-й хромосоме наблюдались ложноположительные результаты. Поэтому, несмотря на высокую чувствительность ДНК-скрининга при выявлении анеуплоидий по 13-й и половым хромосомам, специфичность диагностики ниже, чем для 21-й и 18-й хромосом.
Суммарная чувствительность ДНК-скрининга по 21, 18, 13-й и половым хромосомам в первой выборке составила 100% (94,04–100%), специфичность – 98,97% (96,33–99,87%). PPV составила 96,77% (88,83–99,61%), NPV – 100% (98,10–100%). Общая эффективность теста при анализе анеуплоидий по хромосомам 21, 18, 13, X и Y, определяемая как доля истинных результатов среди всех проведенных исследований, составила 99,21% (97,18–99,90%).
В смешанной группе из 270 женщин (выборка 2) сроки беременности составляли от 10 до 18 недель (в среднем 14 недель). Среднее содержание доли ДНК плода в образцах составило 11,2%. В пяти образцах уровень плодовой ДНК был менее 5,0%. У этих женщин осуществлен повторный забор крови через 2 недели. Содержание внеклеточной ДНК плода в этих пяти образцах после повторного забора на более позднем сроке составляло не менее 5%.
Для всех 270 образцов периферической крови беременных женщин с достаточной долей плодовой ДНК отсутствие или наличие основных трисомий плода было определено неинвазивно молекулярно-генетическим методом. Отсутствие анеуплоидий у плода по данным ДНК-скрининга по крови матери было установлено в 258 наблюдениях. Во всех этих случаях беременность завершилась родами фенотипически нормальным ребенком.
По результатам исследований выявлены 12 анеуплоидий по 21, 18-й и Х хромосомам, не получено ложноотрицательных результатов и получен один ложноположительный результат по хромосоме 21 (табл. 2).
Таким образом, чувствительность метода составила 100,00% (71,51–100%), специфичность – 99,61% (97,87–99,99%). PPV составила 91,67% (61,52–99,79%), NPV – 100% (98,58–100%).
В исследованиях на обеих выборках ДНК-скрининг продемонстрировал высокую чувствительность и специфичность для диагностики анеуплоидий плода по крови матери. Частота выявления анализируемых анеуплоидий в первой выборке составила 23,6%, тогда как во второй всего 4,1%, что объясняется особенностями формирования групп. Первая выборка состояла из беременных с высоким риском анеуплоидий по данным биохимического скрининга, тогда как во второй преобладали беременные с низким риском хромосомных аномалий. Тем не менее, посттестовые вероятности наличия анеуплоидий при положительном результате ДНК-скрининга (PPV) в обоих выборках были очень близки: 96,77% (88,83–99,61%) и 91,67% (61,52–99,79%) соответственно. Это дало основание для объединения результатов, полученных в первом и втором исследованиях (табл. 3).
Полученные результаты в целом соответствуют литературным данным (табл. 4), что позволяет опираться на значения NPV и PPV, рассчитанные на основании литературных данных для большой выборки при формировании лабораторного заключения.
Обсуждение
Приведенные литературные данные, а также результаты, полученные в российских лабораториях, демонстрируют, что предсказательная ценность отрицательного результата ДНК-скрининга по крови матери крайне высока и позволяет с высокой вероятностью (>99,9%) исключить наличие анеуплоидий по 21, 18, 13-й и половым хромосомам. Это значительно превышает показатели применяемого в настоящее время комбинированного скрининга, основанного на данных УЗИ и показателях биохимических маркеров, хотя и не может полностью исключить наличие анеуплоидий при отрицательных результатах. В первую очередь наличие ложноотрицательных результатов может быть связано с низкой долей плодовой ДНК, что требует включения в лабораторное исследование этапа определения доли плодовой ДНК в исследуемом образце. Также нельзя исключить и ошибки, связанные с биологическими причинами, например, наличием мозаицизма, полиплоидии, замершей беременности и др. Помимо этого, у плода могут иметься пороки развития, не связанные с хромосомной патологией. Поэтому отрицательный результат ДНК-скрининга не может рассматриваться как показание для отмены таких диагностических мероприятий, как проведение ультразвукового обследования на более поздних сроках беременности.
Весьма высока по сравнению с комбинированным скринингом и предсказательная ценность положительного результата. Несмотря на то что положительный результат ДНК-скрининга не отменяет необходимости в проведении подтверждающих диагностических мероприятий, он позволяет сформировать группу риска со значительно большей точностью по сравнению с другими видами скрининга. Поэтому применение ДНК-скрининга позволит значительно снизить количество проводимых инвазивных процедур.
Результаты исследования подтверждают, что ДНК-скрининг позволяет с высокой точностью определять пол плода. В связи с этим, высказываются опасения, что существует вероятность использования полученных результатов в немедицинских целях, например, для селекции по полу [12]. Поэтому представляется нецелесообразной выдача пациенту информации о поле плода на ранних сроках беременности, когда по действующему законодательству допускается прерывание беременности без медицинских показаний. Исключение может быть сделано только при наличии в семье сцепленных с полом наследственных заболеваний или при выявленных у плода нарушениях по числу половых хромосом (например, при выявлении у плода женского пола моносомии по X-хромосоме).
Заключение
ДНК-скрининг анеуплоидий плода по крови матери обладает значительно более высокими чувствительностью и специфичностью по сравнению с применяемым в настоящее время комбинированным скринингом, что позволяет рекомендовать применение ДНК-скрининга большинству беременных женщин. При этом при проведении ДНК-скрининга необходимо измерение доли плодовой ДНК, которая должна быть не ниже порога чувствительности метода (около 4%). Благоприятные результаты ДНК-скрининга позволяют с высокой вероятностью исключить анеуплоидии плода по исследуемым хромосомам, в том числе при решении врачами акушерами-гинекологами вопроса о пролонгировании беременности на ранних сроках у женщин с угрожающим и привычным выкидышем. При выявлении высокого риска хромосомных нарушений с помощью ДНК-скрининга по крови матери необходимо проведение медико-генетического консультирования и выполнение подтверждающих диагностических инвазивных процедур.
Внедрение ДНК-скрининга по крови матери как рутинного скрининга беременных может совершить прорыв в оказании помощи беременным женщинам, позволит снизить число проводимых инвазивных процедур, при этом существенно уменьшить частоту рождения детей с тяжелыми инвалидизирующими заболеваниями и перинатальную смертность.



