В настоящее время вспомогательные репродуктивные технологии (ВРТ) широко применяются для лечения бесплодия, и с каждым годом количество пациентов, проходящих программу ЭКО, увеличивается, однако процент эффективности лечения остается достаточно низким [1].
Основной задачей стимуляции функции яичников в программах экстракорпорального оплодотворения является получение достаточного количества фолликулов и зрелых ооцитов с целью выбора большего числа эмбрионов высокого качества для переноса в полость матки [2]. Одним из ведущих этапов успешного лечения бесплодия при использовании методов ВРТ является выбор эмбриона с высоким потенциалом к имплантации [3, 4], однако в настоящее время качество переносимых эмбрионов оценивается согласно морфологическим критериям, включающим скорость и своевременность деления клеток, форму бластомеров, степень фрагментации и другие [5].
Точность такого метода отбора эмбрионов недостаточно высока, хотя его использование и привело к значительному повышению результативности программ ЭКО [6]. Таким образом, дальнейшее развитие точных малоинвазивных объективных методов оценки качества ооцитов и эмбрионов с высоким потенциалом к имплантации является одной из наиболее важных направлений репродуктивной медицины [7, 8].
Известно, что процесс фолликулогенеза и оогенеза напрямую зависит от взаимосвязи между ооцитом и окружающими его соматическими клетками [9]. В процессе фолликулогенеза на этапе образования полости внутри фолликула соматические клетки дифференцируются на 2 различных анатомических и функциональных слоя: клетки муральной гранулезы, выстилающие полость фолликула и ответственные за стероидогенез, и кумулюсные клетки, непосредственно окружающие ооцит [10]. В конечном итоге формируется зрелый ооцит-кумулюсный комплекс (ОКК), в котором кумулюсные клетки остаются тесно связанными с ооцитом посредством специальных щелевых контактов, позволяющих осуществлять метаболический обмен и транспорт сигнальных молекул [11]. Таким образом, окружающие ооцит соматические клетки оказывают непосредственное влияние на рост и развитие фолликула, возобновление мейоза, регулируют транскрипционную активность, а также ядерное и цитоплазматическое созревание ооцита за счет активации различных сигнальных путей [12].
Ооцит, в свою очередь, продуцирует растворимые факторы роста (ооцит секретируемые факторы – OSF) – фактор роста и дифференциации 9 (GDF9) и костный морфологический белок-15 (BMP-15), необходимые для роста окружающих фолликулярных клеток на разных этапах развития [10]. Эти факторы роста активируют сигнальные пути и индуцируют экспрессию ряда генов, регулирующих широкий спектр функций гранулезных и кумулюсных клеток, включающий дифференцировку, пролиферацию, апоптоз и лютеинизацию [10, 13].
Помимо этого, ооцит-секретируемые факторы регулируют экспрессию ряда генов, ответственных за процесс экспансии кумулюсных клеток, характеризующийся ростом кумулюсных клеток с одновременной потерей тесных контактов между клетками [7, 14]. В процессе экспансии кумулюсные клетки продуцируют гиалуроновую кислоту, которая откладывается на экстрацеллюлярном матриксе, связывающем вместе ооцит и кумулюсные клетки [15]. Эта уникальная способность клеток кумулюса подвергаться экспансии необходима для нормального развития ооцита и его овуляции [16].
Таким образом, связь между ооцитом и кумулюсными клетками является двунаправленной: кумулюсные клетки ответственны за развитие и созревание ооцитов, а ооциты, в свою очередь, играют важную роль в пролиферации и развитии окружающих их фолликулярных клеток [17]. Жизненно важная роль кумулюсных клеток заставила ученых сосредоточиться на их исследовании [8, 18].
Цель исследования: поиск молекулярно-генетических маркеров для оценки качества эмбрионов с высоким потенциалом к имплантации с целью повышения эффективности лечения бесплодия при помощи методов ВРТ.
Материал и методы исследования
На базе отделения вспомогательных технологий в лечении бесплодия и лаборатории молекулярно-генетических методов ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России проведено ретроспективное исследование случай-контроль.
Был исследован уровень экспрессии мРНК 5 генов в кумулюсных клетках методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) в режиме реального времени: гены внеклеточного матрикса (гиалуронан-синтетаза 2 (HAS2), версикан (VCAN)), а также гены, регулирующие передачу внутриклеточной информации (простагландин синтетаза 2 (PTGS2), гремлин (GREM1), инозитол-трифосфат 3 киназы А (ITPKA)) (реактивы ДНК-Технология, Россия).
Во избежании деградации РНК взятие материала (кумулюсные клетки) осуществляли в пробирки с раствором гуанидинтиоционата (лизирующий раствор наборы «Проба НК»). Осаждение РНК проводили изопропанолом в присутствии соосадителя, с последующими отмывками промывочными растворами. В реакции обратной транскрипции использовали смесь специфических олигонуклеотидов всех исследуемых генов. Амплификацию осуществляли в режиме реального времени с измерением уровня флуоресценции по каналу FAM на каждом цикле при температуре отжига праймеров. Реализация «горячего старта» обеспечивалась использованием Taq-полимеразы, активность которой блокирована антителами и восстанавливается при прогреве. Реакцию ставили в двух повторах для каждой точки. Уровень экспрессии измеряли в относительных единицах (о.е.) относительно референсных генов TBP, B2M, GUSB методом сравнения пороговых циклов (∆Cq).
В исследование были включены 39 пациенток, соответствовавших критериям включения (возраст 18–36 лет, женское бесплодие трубного происхождения, мужской фактор бесплодия при отсутствии тяжелой патозооспермии, регулярный менструальный цикл, проведение интрацитоплазматической инъекции сперматозоида в ооцит – ИКСИ). Критериями невключения явились эндокринный фактор бесплодия, эндометриоз III–IV степени распространения, генетические аномалии, пороки развития половых органов и другие. Женщины были разделены 2 группы в зависимости от исхода лечения: I группа – 14 женщин, у которых в результате лечения наступила клиническая беременность (проанализировано 14 образцов кумулюсных клеток, перенесено 14 эмбрионов), II группа – 25 женщин с отсутствием наступления беременности (проанализировано 25 образцов кумулюсных клеток, перенесено 25 эмбрионов).
Стимуляция суперовуляции проводилась препаратами гонадотропинов по протоколу с антагонистом гонадотропин-рилизинг гормона со 2–3-го дня менструального цикла.
Морфологическая оценка качества эмбрионов была произведена согласно классификации, принятой Istanbul consensus workshop on embryo assessment (ESHRE, 2011) («модифицированная» классификация D. Gardner) [19].
Исследование было одобрено комитетом по этике ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. Статистическая обработка данных выполнена с помощью пакета прикладных программ SPSS Statistics 17.0. Для оценки значимости межгрупповых различий применяли тест Стьюдента для 2 независимых выборок. При исследовании двух выборок использовали критерий Манна–Уитни для несвязанных совокупностей. Статистически значимыми считались различия при р<0,05. Отношение шансов (ОШ) приведено с 95% доверительным интервалом.
Результаты
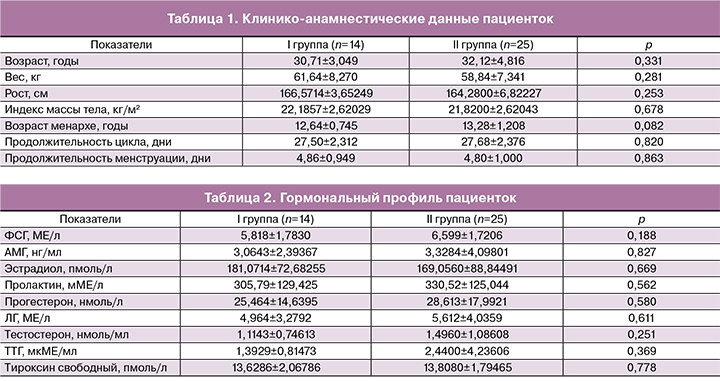
Анализ возрастных характеристик пациенток, включенных в исследование, не выявил статистически значимых различий. Средний возраст женщин в I группе составил 30,71±3,049 года; во II группе – 32,12±4,816 года.
Пациентки в исследуемых группах были сопоставимы по параметрам овариального резерва (уровень ФСГ, АМГ и количество антральных фолликулов в раннюю фолликулярную фазу по данным ультразвуковго исследования органов малого таза). Также не было выявлено статистически значимых различий в частоте распространения гинекологических и экстрагенитальных заболеваний между группами. При оценке репродуктивной функции женщин было выявлено, что случаи первичного и вторичного бесплодия встречались с одинаковой частотой в исследуемых группах. Клинико-анамнестические данные и гормональный профиль пациенток представлен в табл. 1 и 2 соответственно.
 В ходе проведенного исследования установлено, что в группе женщин, у которых наступила клиническая беременность, наблюдалось повышение уровня экспрессии мРНК гена гиалуронан синтетазы 2 (HAS2) в 1,5 раза (тест Манна–Уитни, р=0,018). Статистически значимой ассоциации экспрессии мРНК гена HAS2 с качеством эмбрионов согласно морфологическому критерию оценки на 5-е сутки развития по данному показателю выявлено не было. Однако результаты ранее проведенных исследований продемонстрировали существенную связь между уровнем экспрессии HAS2 в кумулюсных клетках и качеством развивающихся эмбрионов [20, 21].
В ходе проведенного исследования установлено, что в группе женщин, у которых наступила клиническая беременность, наблюдалось повышение уровня экспрессии мРНК гена гиалуронан синтетазы 2 (HAS2) в 1,5 раза (тест Манна–Уитни, р=0,018). Статистически значимой ассоциации экспрессии мРНК гена HAS2 с качеством эмбрионов согласно морфологическому критерию оценки на 5-е сутки развития по данному показателю выявлено не было. Однако результаты ранее проведенных исследований продемонстрировали существенную связь между уровнем экспрессии HAS2 в кумулюсных клетках и качеством развивающихся эмбрионов [20, 21].
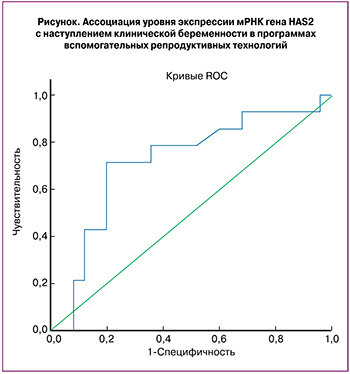
Уровень экспрессии мРНК гена HAS2 может быть использован в качестве предиктора результативности программ ВРТ. Площадь под кривой составила 0,72 (ДИ: 0,54–0,89, p=0,026) (рисунок). Согласно проведенному ROC-анализу, при уровне отсечки положительного результата 0,43 о.е. чувствительность и специфичность метода составляет 71,4% и 80% соответственно при выборе требования максимальной суммарной чувствительности и специфичности.
В ходе нашего исследования не было выявлено статистически значимых различий между качеством перенесенных эмбрионов и показателем наступления клинической беременности (χ2 тест, p=0,864).
Обсуждение
В попытке идентифицировать новые методы диагностики качества эмбрионов, которые могли бы использоваться отдельно или совместно с используемой в практике морфологической оценкой, ученые остановили свое внимание на альтернативных малоинвазивных методах исследования, основанных на оценке качества ооцита и/или эмбриона по уровню транскрипционной активности в кумулюсных клетках.
Одним из главных факторов, необходимых для нормального развития ооцита и овуляции является способность клеток кумулюса подвергаться экспансии [22], в ходе которой клетки кумулюса продуцируют гиалуроновую кислоту, являющуюся главным компонентом внеклеточного матрикса, связывающего вместе ооцит и кумулюсные клетки [15].
Известно, что гиалуроновая кислота играет важную роль в процессах овуляции, оплодотворения и эмбриогенезе [23]. Главным ферментом, необходимым для синтеза гиалуроновой кислоты кумулюсными клетками, является HAS2 [24]. Функция гиалуроновой кислоты реализуется за счет взаимодействия с ее рецепторами, такими как CD44. HAS2, связываясь с рецептором CD44, стимулирует клеточную пролиферацию, индуцирует передачу внутриклеточной информации, а также обладает ангиогенным и иммунностимулирующим действиями [25].
По результатам ранее проведенных исследований была выявлена значимая корреляция между уровнем экспрессии HAS2 и синтезом гиалуроновой кислоты [14], а также степенью экспансии клеток кумулюса [26]. Секреция HAS2 контролируется ооцит-секретируемым паракринным фактором роста и дифференциации 9 (GDF9) и является необходимым ферментом для финального созревания ооцита, а также для его связывания со сперматозоидом [24]. По данным иследования Marei и др. в условиях сниженного синтеза гиалуроновой кислоты происходит остановка развития эмбриона до момента достижении им стадии бластоцисты [23].
В ходе проведенного нами исследования было установлено, что в группе женщин, у которых в результате лечения в программе ЭКО (ИКСИ) наступила клиническая беременность, наблюдалось повышение уровня экспрессии мРНК гена гиалуронан синтетазы 2 (HAS2), показывающее, что HAS2 может являться потенциальным предиктором оценки результативности программ ВРТ. Однако, результаты исследования Anderson и соавт. [27] не выявили значимой корреляции между уровнем экспрессии мРНК гена HAS2 и частотой наступления беременности. В ходе нашего исследования не было выявлено статистически значимых различий между качеством перенесенных эмбрионов и показателем наступления клинической беременности (χ2 тест, p=0,864). Однако, результаты ранее проведенных исследований продемонстрировали существенную связь между уровнем экспрессии HAS2 в кумулюсных клетках и качеством развивающихся эмбрионов [20, 21].
Еще одним GDF9-зависимым геном является ген гремлин (GREM1)- антагонист костного морфологического белка [28]. Считается, что гремлин осуществляет регуляцию функции кумулюсных клеток через ооцит-секретируемые факторы (GDF9 и BMP15) за счет селективного ингибирования костного морфологического белка, но не фактора роста и дифференцировки 9 [27, 28]. Являясь селективным игнгибитором BMP15, гремлин предотвращает преждевременную лютеинизацию клеток кумулюса [28]. По данным исследования Wathlet и соавт. [29] уровень экспрессии мРНК гена GREM1 был выше у женщин с наступившей беременностью при проведении программ ВРТ с антагонистами гонадотропин-рилизинг гормона по сравнению с агонистами. По данным проведенного нами исследования не было выявлено статистически значимых различий между уровнем экспрессии мРНК гена GREM1 и показателем наступления беременности. Это подтверждает ранее проводимые исследования Anderson и соавт. [27], также не выявившие значимой корреляции между показателями экспрессии мРНК гена GREM1 и частотой наступления беременности.
Ген простагландин-синтетаза 2 (PTGS2) играет важную роль в реализации репродуктивной функции, принимая участие в процессах овуляции, оплодотворения, имплантации и родах [30]. Экспрессия PTGS2 регулируется ооцит-секретируемым паракринным фактором (GDF9), и наряду с HAS2 принимает участие в передаче внутриклеточной информации и формировании внеклеточного матрикса [21, 29].
Ген версикан (VCAN), относящийся к семейству протеогликанов, является одним из главных компонентом внеклеточного матрикса [30]. Он вовлечен в процесс клеточной адгезии, а также принимает участие в пролиферации и миграции клеток, ангиогенезе, апоптозе и играет ключевую роль в построении тканей и стабилизации белков внеклеточного матрикса [31]. В своих исследованиях Gebhardt и соавт. показали, что уровень экспрессии генов версикан (VCAN) и PTGS2 был значительно выше в кумулюсных клетках ооцитов, перенос эмбрионов от которых привел к наступлению беременности и рождению живого ребенка [32]. Однако по результатам исследования Wathlet и соавт. не было обнаружено значительных различий в уровне экспрессии VCAN у женщин с наступившей беременностью по сравнению с женщинами, у которых беременность не наступила, в то время как прослеживалась четкая связь между экспрессией мРНК гена инозитол-трифосфат 3 киназы А (ITPKA) – ключевого фермента, регулирующего передачу внутриклеточных сигналов, и показателем наступления беременности [33].
ITPKA инициирует превращение инозитол-1,4,5-трифосфата (ИФ3) в инозитол-1,3,4,5-тетрафосфат (ИФ4), что приводит к высвобождению Ca2+ из эндоцитоплазматического ретикулума [34]. Кальций необходим для функционирования клеточных мембран, а также работы ядерного аппарата клетки. В ядре ионы Са2+ участвуют в поддержании структуры хроматина, в митохондриях и хлоропластах они играют важную роль в регуляции активности ферментов.
По данным проведенного нами исследования не было выявлено статистически значимых различий между уровнем экспрессии мРНК генов PTGS2,VCAN и ITPKA и показателем наступления беременности. Это подтверждает недавно проведенные исследования Papler и соавт., также не выявившие корреляции между уровнем экспрессии мРНК данных генов и показателями оплодотворения, имплантации [35] и наступления клинической беременности [36].
Накопленные на сегодня данные подтверждают перспективность изучения профиля экспрессии генов в кумулюсных клетках для оценки качества ооцитов и эмбрионов. Проведенные исследования по оценке уровня экспрессии HAS2 и его влиянии на развитие эмбрионов и результаты программ ЭКО/ИКСИ демонстрируют обнадеживающие результаты, которые могут быть применены в клинической практике для оптимизации выбора переносимых эмбрионов.
Заключение
Ген HAS2 может являться потенциальным предиктором оценки результативности программ ВРТ, не связанным непосредственно с качеством эмбриона согласно морфологическим критериям. Оценка уровня экспрессии мРНК гена HAS2 в кумулюсных клетках может служить малоинвазивным тестом, применяемым в клинической практике для оптимизации выбора переносимых эмбрионов c целью повышения результативности программ ЭКО.



