Проблема железодефицитных состояний (ЖДС) у беременных и родильниц остается весьма актуальной в практическом акушерстве в связи с ее высокой распространенностью и неблагоприятным влиянием дефицита железа на течение беременности, родов, послеродового периода, состояние плода и новорожденного [1].
Частота железодефицитной анемии (ЖДА) у беременных в мире в среднем колеблется от 25 до 50%. В развивающихся странах ее распространенность у женщин репродуктивного возраста составляет 40–50%, а в развитых – до 18–20%. Различные авторы полагают, что к концу беременности ЖДА развивается у всех без исключения беременных [2].
В индустриально развитых странах женщины вступают в беременность с нормальными запасами железа. Вместе с тем, ряд авторов склоняются к профилактике у всех беременных во II и III триместрах. Такая профилактика является общепризнанной и достаточно распространенной в России и за рубежом [3]. В настоящее время ВОЗ предлагает 60 мг/сут железа + 400 мкг/сут фолиевой кислоты беременным во II и III триместрах для всех регионов проживания [4]. Американский колледж акушеров и гинекологов рекомендует проводить для всех беременных женщин скрининг на анемию и пренатальное профилактическое назначение железосодержащих витаминных добавок, а при выявлении анемии – начинать адекватную терапию препаратами железа [5, 6]. В соответствии с этим в рекомендациях Департамента здоровья США подчеркнута целесообразность применения у женщин репродуктивного возраста богатых железом пищевых добавок и продуктов, которые повышают всасывание железа в организме, а у беременных женщин – ежедневный прием железосодержащих поливитаминных препаратов [7]. В противоположность вышесказанному Национальный институт Великобритании считает необходимым назначать препараты железа только пациенткам с концентрацией гемоглобина <110 г/л в первом триместре и <105 г/л – с 28-й недели беременности [8].
Данные Кохрейновского обзора о последствиях и безопасности приема препаратов железа и фолиевой кислоты во время беременности показали эффективное увеличение концентрации гемоглобина и снижение риска развития анемии у женщин, получающих как прерывистый курс, так и ежедневный прием железа и фолиевой кислоты [9]. Однако обновленный обзор о приеме препаратов железа при беременности выявил, что ежедневный прием железосодержащих препаратов является лучшим для предотвращения ЖДА у матерей и дефицита железа во время беременности, а также для снижения риска рождения детей с низкой массой тела.
В настоящее время основные проблемы в терапии ЖДА связаны с переносимостью и возникновением побочных эффектов препаратов железа в зависимости от их форм. Поэтому для успешного восполнения запасов железа крайне важно определять наиболее подходящую лекарственную форму и дозу препарата, а также продолжительность лечения [10]. Несмотря на неизменный интерес и достижения во внедрении новых железосодержащих препаратов, ни одно из оздоровительных мероприятий в масштабах регионов или целых стран не привело к решению даже отдельных вопросов этого международного междисциплинарного мультифакторного аспекта ухудшения здоровья женщин вне и особенно во время беременности, а также нарушений состояния их плодов и новорожденных.
Анемия у беременных, особенно в тех случаях, когда она наблюдалась до наступления беременности, существенно увеличивает перинатальные потери и заболеваемость новорожденных.
Доказанным при анемии беременных можно считать:
- повышение перинатальной смертности (ПС) (14–32%);
- повышение перинатальной заболеваемости (ПЗ) до 1000‰;
- задержку развития плода (ЗРП) – 32%;
- гипоксию – 63%;
- гипоксическую травму мозга – 40%;
- инфекционно-воспалительные заболевания – 37% (больше, чем при хроническом пиелонефрите).
К сожалению, проводимая во время беременности терапия железосодержащими препаратами различных производителей в несопоставимых ценовых диапазонах дает практически одинаковый, неудовлетворительный с позиций перинатологии эффект.
Возможными причинами этого могут быть:
- запаздывание лечебных мероприятий – начало лечения после 25 недель;
- нарушение формирования плацентарного ложа и ранней плаценты вследствие анемической ангиопатии;
- иммунная недостаточность у женщин с циркуляторным гипоксическим синдромом;
- дефицит аминокислот и белков-предшественников для синтеза белковой субъединицы гемоглобина.
Эти и другие обстоятельства в профилактике и лечении перинатальных осложнений у новорожденных от матерей с анемией наряду с отсутствием единых стандартов диагностики, а главное – лечения ее, актуализируют необходимость решения ряда вопросов, главными из которых мы считаем:
- сроки начала лечения;
- оптимальный комплекс оздоровительных факторов (медикаментозное и немедикаментозное лечение);
- критерии эффективности терапии;
- особенности родоразрешения женщин с анемией.
Цель исследования – оценить эффективность антианемической терапии в профилактике плацентарной недостаточности (ПН) во втором триместре беременности.
Материал и методы исследования
В рамках исследования проанализировано течение и исход настоящей беременности у 40 пациенток во II триместре с верифицированным диагнозом ЖДА, которые получали антианемическую терапию в комплексе с препаратами для коррекции ПН во II триместре беременности. 15 пациенток с неосложненным течением беременности составили контрольную группу.
Критерием включения послужило наличие анемии, предшествующей данной беременности, подтвержденное терапевтом, при наличии двух и более сопутствующих экстрагенитальных заболеваний выбор основного заболевания определялся его тяжестью.
С момента выявления анемии пациентки получали сидерал форте, избранный в качестве железосодержащего препарата и включенный в комплекс лечения анемии во II триместре беременности и медикаментозную профилактику плацентарной недостаточности (в сроках 17–24 недели) в виде метаболического комплекса: диета (полноценный белок, олигопептиды, полиненасыщенные жирные кислоты); сумма токоферолов; терапия по сохранению беременности.
Разработана программа исследований, предусматривающая клинико-статистический анализ, комплекс биохимических, ультразвуковых исследований и математическую обработку полученных результатов.
Клиническую оценку состояния здоровья обследованных женщин проводили с помощью разработанной нами статистической карты. Анемию выявляли совместно с профильными специалистами в результате комплекса клинических, лабораторных и функциональных исследований по специально разработанной программе.
Лабораторная диагностика анемии основывалась на определении содержания гемоглобина, эритроцитов, тромбоцитов, сывороточного железа, ферритина.
Ультразвуковое исследование, включавшее фето- и плацентометрию, проводили на аппарате «Medison Sono Aec 8800» (Южная Корея). При допплерометрическом исследовании оценивалась выраженность гемодинамических нарушений в маточных артериях (МА) и в радиальных артериях (РА) с определением индекса резистентности (ИР).
Статистическая обработка данных проведена при помощи пакета модулей Statistica for Windows, Release 9.0 компании StatSoft Inc., США (2010).
Результаты исследования
Клинико-статистический анализ состояния соматического и репродуктивного здоровья обследованных пациенток показал, что в целом группы были сопоставимы по основным анализируемым параметрам. Средний возраст беременных с анемией составил 24,4±1,5 года и не отличался от возраста здоровых беременных (22,6±1,2, p>0,05). 19 (47,5%) пациенткам с анемией и 8 (53,3%) контрольной группы предстояли первые роды, 21 (52,5%) и 7 (46,7%) соответственно – повторные. Интергенетический интервал в группе беременных с анемией у 10 (25%) составил менее чем год, 5 (12,5%) – 1,5 года, 6 (15%) – два года. Таким образом, интервал между настоящими и предыдущими родами до двух лет был у всех 40 пациенток. У 35 (87,5%) беременных, помимо анемии, диагностированы другие экстрагенитальные заболевания: сердечно-сосудистой системы у 7 (17,7%); хронический тонзиллит – у 7 (17,7%); хронические бронхолегочные заболевания – у 2 (5%); заболевания щитовидной железы – у 2 (5%); заболевания мочевыделительной системы (хронический цистит, хронический пиелонефрит) – у 19 (47,5%).
Гинекологические заболевания были у 27 (49,1%) пациенток в обеих группах, причем преобладали воспалительные заболевания придатков – они отмечались у 22 (55%) пациенток с анемией и у 7 (46,7%) – контрольной группы. Перечисленные соматические и гинекологические заболевания и осложнения акушерско-гинекологического анамнеза создавали неблагоприятный фон для развития беременности, вызывая отклонения в течении гестации.
При анализе исхода предыдущих беременностей у женщин с анемией обращает на себя внимание, что у каждой четвертой были преждевременные роды. Среднее количество медицинских абортов, которые предшествовали настоящей беременности, у пациенток с анемией было достоверно больше (p<0,05), чем у женщин контрольной группы. Практически каждая третья пациентка с анемией перенесла ранее медицинский аборт, а каждой четвертой их производили неоднократно.
Практически каждый пятый ребенок (n=8, 20%) при предыдущих родах у беременных с анемией на фоне нефропатии родился с гипотрофией, у двух (5%) были врожденные аномалии развития. В группе пациенток с анемией перинатальная смертность составила 18,7‰, причем была зафиксирована только постнатальная летальность.
Среди осложнений настоящей беременности ранний токсикоз занимал лидирующее положение, составив в целом у женщин с анемией 22 случая (55%), угроза прерывания беременности имела место у каждой третьей женщины. Сочетание двух и более осложнений во время беременности были у каждой четвертой беременной с анемией.
Таким образом, клинико-статистический анализ состояния соматического и репродуктивного здоровья обследованных пациенток выявил тенденции, а не достоверные отличия от здоровых, что зачастую приводит к недооценке риска сочетания анемии и осложнений беременности в динамике ее развития.
В основу комплексной коррекции ПН во II триместре беременности при анемии нами были положены:
- диета (полноценный белок, олигопептиды, полиненасыщенные жирные кислоты;
- сумма токоферолов;
- антианемический препарат сидерал форте;
- терапия по сохранению беременности (по показаниям);
- коррекция микробиоценоза гениталий.
Комплексная метаболическая терапия положительно повлияла на клиническое течение беременности. Об этом свидетельствует быстрая нормализация общего состояния, исчезновение у беременных признаков угрозы прерывания.
Субъективные симптомы анемии купировались к 10–12-м суткам приема препарата. Из субъективных признаков быстрее всего регрессировала одышка при физической нагрузке, исчезли головокружение и общая слабость, а среди объективных признаков – бледность слизистых оболочек, в то время как бледность кожных покровов сохранялась до 20 суток приема препарата. В целом отмечена следующая последовательность регресса субъективных и объективных признаков анемии: одышка при физической нагрузке, бледность слизистых оболочек, тахикардия, головокружение, общая слабость и бледность кожных покровов.
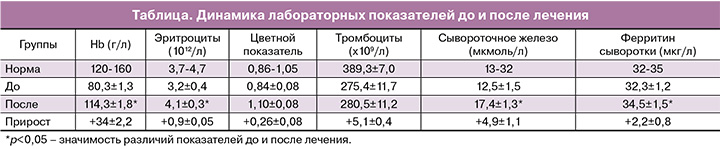
С целью выявления клинико-функциональных изменений в гемопоэзе и ферростатусе при анемии и их влиянии на формирование ПН нами были изучены следующие показатели крови, представленные в таблице.
В процессе лечения препарат сидерал форте обеспечивал достоверное (р<0,001) увеличение уровня гемоглобина с 80,3±1,3 г/л до 114,3±1,8 г/л и эритроцитов – с 3,2±0,4 1012/л до 4,1±0,3 1012/л. Отмечалось достоверное увеличение уровня сывороточного железа (с 12,5±1,5 мкмоль/л до 17,4±1,3 мкмоль/л) и существенный прирост уровня ферритина, который возможен только при наименьшей скорости прироста гемоглобина. Так, при оценке депо железа по уровню ферритина сыворотки крови оказалось, что при приеме препарата сидерал форте возросли запасы железа. Прирост уровня ферритина сыворотки крови имел тенденцию к превышению на фоне лечения с 32,3±1,2 мкг/л до 34,5±1,5 мкг/л.
На наш взгляд, индивидуальный подход к железозаместительной терапии, основанный главным образом на определении феррокинетических показателей, представляется более целесообразным. Данный подход позволяет более рационально осуществлять восполнение недостаточности железа в организме там, где это действительно необходимо, снизить риск приема дополнительного железа во время беременности. Помимо этого, необходимо учитывать возможность повышения массы циркулирующих эритроцитов и соответственно вязкости крови при ряде состояний, при которых это может представлять повышенный риск для беременной.
На индивидуальном подходе основывается стратегия Норвежского совета по здравоохранению (Norwegian Board of Health), рекомендующего проводить железозаместительную терапию на основании определения уровня сывороточного ферритина в сроки до 12 нед беременности. Если концентрация ферритина составляет менее 15 мкг/л, прием препаратов железа должен начинаться незамедлительно. При содержании ферритина 15–20 мкг/л железозаместительная терапия рекомендуется с 13–14-й недели беременности, при уровне ферритина 20–60 мкг/л – с 20-й недели. При содержании ферритина более 60 мкг/л профилактического приема препаратов железа не требуется.
Из представленных данных следует, что при анемии результаты исследования демонстрировали тенденцию изменений показателей периферической крови после лечения. Вместе с тем основной целью проводимой терапии было не повышение уровня гемоглобина и количества эритроцитов, а профилактика и лечение признаков ПН у беременных с анемией во II триместре.
Эффективность комплексной метаболической терапии определялась нормализацией компенсаторных процессов в тканях материнского и плодового организмов, что способствовало созданию оптимальных условий для функционирования системы «мать – плацента – плод». Это подтверждается результатами допплерометрических исследований. Результаты лечения оценивались по динамике ультразвуковых показателей. У всех женщин с анемией на протяжении беременности зафиксированы изменения маточно-плацентарного кровотока, вероятно, вследствие ангиопатии сосудов. Вместе с тем после назначенной терапии отмечалось повышение периферического сосудистого сопротивления в динамике всего II триместра беременности. IR МА увеличивался с 0,66±0,00 до 0,83±0,017 в 17–24 недели IR РА статистически достоверно отличался после лечения от аналогичных показателей до на протяжении всего триместра беременности и также характеризовался постепенным повышением от 0,48±0,005 до 0,76±0,001 в 17–24 недели. То есть после курса комплексной метаболической терапии у пациенток с анемией было отмечено значительное улучшение данных допплерометрии. Показатели маточно-плацентарного кровотока повысились на 34%.
Таким образом, профилактика и лечение ранней плацентарной недостаточности у женщин с анемией позволили восстановить физиологическое повышение диастолического компонента кровотока, характерного для периода гестационных изменений спиральных артерий, обусловленных второй волной эндоваскулярной миграции трофобласта.
Заключение
Высокая частота осложнений беременности делают чрезвычайно актуальными вопросы ранней диагностики и прогнозирования ЖДА, ее своевременной и рациональной профилактики и лечения. Назначение сидерала форте в дозе 1 капсула (30 мг железа) в день для лечения ЖДА в комплексной коррекции ПН позволяет добиться не только нормализации показателей железа, улучшения качества жизни беременных, но и снижения частоты развития акушерских и перинатальных осложнений.



