1. ВВЕДЕНИЕ
Высокопроизводительное секвенирование и молекулярное кариотипирование на микроматрицах широко используются для диагностики моногенных заболеваний и хромосомных нарушений. Сокращение сроков выполнения исследований обеспечило возможность применения этих методов диагностики пренатально, в том числе в рамках продолжающейся беременности. При этом вопрос о правилах проведения анализа и сообщения результатов стоит особенно остро, поскольку при продолжающейся беременности результаты исследования неизбежно влияют на принятие решений по пролонгированию или прерыванию беременности. В связи с этим не должен проводиться анализ вариантов, не имеющих отношение к показаниям к проведению исследования, а также вариантов в генах, для которых не описана связь с конкретными генетическими заболеваниями. Включение в заключение вариантов неопределенной клинической значимости целесообразно только в случаях, когда возможно уточнение значимости при проведении дополнительных исследований после обсуждения специалистами мультидисциплинарной команды.
Способы получения биоматериала накладывают дополнительные требования на наличие контролей качества. При проведении пренатального исследования необходим контроль уровня контаминации биоматериалом матери.
Из-за необходимости получения результатов в максимально короткие сроки тактика назначения исследований может отличаться от применяемой обычно. Предпочтительно одновременно проводить исследование плода и родителей, возможно одновременное назначение нескольких видов исследований.
Все особенности проводимого анализа и возможные результаты рекомендуется обсуждать с пациентами во время претестового консультирования и указывать в информированном согласии.
2. Список сокращений
- ВПР – врожденный порок развития
- ДНК – дезоксирибонуклеиновая кислота
- МК – мультидисциплинарная команда
- МПС – массовое параллельное секвенирование
- НИПС – неинвазивный пренатальный скрининг
- ОКС – обсуждение клинической ситуации
- РНК – рибонуклеиновая кислота
- ХМА – хромосомный микроматричный анализ
- aCGH – array-based comparative genomic hybridization (сравнительная геномная гибридизация)
- ACMG – American College of Medical Genetics and Genomics (Американский Колледж Медицинской генетики и геномики)
- ACOG – American College of Obstetricians and Gynecologists (Американский колледж акушеров и гинекологов)
- ClinGen – Clinical Genome Resource (ресурс, собирающий и определяющий клиническую значимость генов и вариантов для использования в медицине и исследованиях)
- CNV – copy number variations (вариация числа копий)
- FISH – fluorescence in situ hybridization (флуоресцентная гибридизация in situ)
- ISPD – International Society for Prenatal Diagnosis (Международное общество пренатальной диагностики)
- GUS – genes of uncertain significance (ген с неопределенной клинической значимостью)
- NGS – next generation sequencing (высокопроизводительное секвенирование)
- QF-PCR – quantitative fluorescent PCR (количественная флуоресцентная полимеразная цепная реакция)
- SNP – single nucleotide polymorphism (однонуклеотидный полиморфизм)
- SNV – single nucleotide variants (однонуклеотидный варианты)
- VUS – variant of uncertain clinical significance (вариант неопределенной клинической значимости)
3. ОБЩИЕ ПОЛОЖЕНИЯ
1. Настоящие методические рекомендации разработаны в целях повышения качества диагностического процесса в пренатальном периоде и включают правила и процедуры формирования лабораторного заключения по результатам анализа ДНК плода методами высокопроизводительного секвенирования (секвенирования панелей генов, полноэкзомного, полногеномного секвенирования) и молекулярного кариотипирования на микроматрицах, а также особенности информирования женщины (будущих родителей) о таких результатах. Материалом для анализа ДНК плода в пренатальный период обычно служат ворсины хориона, амниотическая жидкость, пуповинная кровь или абортивный материал.
2. Настоящие методические рекомендации базируются на международном и отечественном опыте использования технологий высокопроизводительного секвенирования и молекулярного кариотипирования на микроматрицах, закрепленном в рекомендациях профессиональных сообществ («Руководство по интерпретации данных последовательности ДНК человека, полученных методами массового параллельного секвенирования (MPS)» (ред. 2018 г., версия 2); «Технические стандарты для интерпретации и сообщения информации о конституциональных вариациях числа копий: совместная консенсусная рекомендация ACMG и ClinGen» (ред. 2020 г.); «Использование секвенирования экзома плода в пренатальной диагностике», ACMG (ред. 2020 г.); «Применение хромосомного микроматричного анализа при конституциональных и неопластических заболеваниях: технический стандарт», ACMG (ред. 2021 г.); «Клиническое применение геномного секвенирования плода во время беременности: заявление Канадского колледжа медицинских генетиков» (ред. 2022 г.); «Позиция ISPD по использованию геномного секвенирования для пренатальной диагностики» (ред. 2022 г.) и др.).
3. Настоящие методические рекомендации предназначены для использования врачами-генетиками, врачами-лабораторными генетиками и другими специалистами в области репродуктивного здоровья, в том числе биологами и клиническими биоинформатиками. В рекомендациях не затрагиваются вопросы проведения неинвазивного пренатального скрининга у плода по крови матери (НИПС).
4. Основные термины, используемые в настоящих методических рекомендациях:
Высокопроизводительное секвенирование (англ. next generation sequencing, NGS, секвенирование следующего поколения, массовое параллельное секвенирование, англ. massive parallel sequencing, MPS) – группа методов определения нуклеотидной последовательности ДНК и РНК, основанных на одновременном прочтении большого количества фрагментов нуклеиновых кислот. Отличается высокой производительностью и позволяет получить большой объем генетической информации, может быть реализовано в различных вариантах исследований – панели генов, полный экзом, полный геном.
Молекулярное кариотипирование на микроматрицах (хромосомный микроматричный анализ, ХМА, англ. chromosomal microarray analysis, CMA, сравнительная геномная гибридизация, англ. array-based comparative genomic hybridization, aCGH) – метод молекулярно-генетического исследования кариотипа, основанный на гибридизации ДНК с олигонуклеотидными зондами в формате микроматриц. В зависимости от характеристик используемых микроматриц может иметь разную разрешающую способность, более или менее полно охватывать разные участки генома и давать дополнительную информацию помимо определения числа копий (например, выявлять участки потери гетерозиготности).
SNV (англ. single nucleotide variants) – однонуклеотидный вариант, представляет собой замену одного нуклеотида на другой.
CNV (англ. copy number variations) – вариация числа копий (от 1000 п.н), изменение числа копий протяженного участка генома, может включать гены, экзоны и интроны генов, представлять собой как уменьшение числа копий (делеции), так и увеличение (например, дупликации и трипликации в случае двукратного или трехкратного увеличения соответственно).
Небольшие инсерции и делеции (англ. short insertions/deletions, индел) – небольшие инсерции/делеции размером до нескольких десятков пар нуклеотидов.
Анеуплоидии – изменения кариотипа, при которых число хромосом в клетках не кратно гаплоидному набору.
Полиплоидии – изменения кариотипа с увеличением количества хромосом, при которых число хромосом в клетках кратно гаплоидному набору.
Панели генов – обычно включают в себя экзоны и прилегающие к ним части интронов одного или нескольких генов, а также избранные последовательности ДНК, варианты в которых ассоциированы с конкретной нозологией.
Полный экзом – включает в себя экзоны и прилегающие к ним части интронов всех генов (1–2% генома человека). Обычно содержит в себе регионы большинства SNV и небольших инсерций и делеций, вызывающих моногенные заболевания.
Полный геном – включает в себя более 95% генома человека. За счет отсутствия этапа обогащения полногеномное секвенирование обеспечивает более равномерное покрытие генома, позволяет выявлять SNV, небольшие инсерции и делеции и CNV, а также, при использовании определенных алгоритмов, сложные варианты, такие как сбалансированные/несбалансированные структурные перестройки (например, транслокации, инверсии, инсерции) и экспансии повторов, варианты в митохондриальном геноме. Как правило, полный геном секвенируется с более низком покрытием, чем полный экзом, поэтому хуже выявляет мозаичные варианты.
Вторичные находки – варианты нуклеотидной последовательности, намеренно выявленные в ходе анализа, но не связанные с первичным показанием к проведению анализа (например, варианты, связанные с высоким риском кардиологических заболеваний у пациента с другой моногенной патологией). К вторичным находкам относятся варианты в генах, отвечающих за поддающиеся лечению или профилактике моногенные заболевания, список таких заболеваний и генов приведен в руководстве по интерпретации данных МПС и постоянно пополняется и обновляется с участием международных сообществ, например, Американского колледжа медицинской генетики и геномики (ACMG).
Случайные находки – варианты нуклеотидной последовательности, случайно (непреднамеренно) выявленные в ходе анализа и не связанные с первичным показанием к проведению анализа (например, варианты, ассоциированные с нарушением слуха у пациента с другой моногенной патологией). В отличие от вторичных находок они не ограничены заранее заданными списками, могут включать в себя варианты, связанные с заболеваниями, для которых нет профилактики и/или лечения. Могут включать в себя тяжелые моногенные патологии, проявляющиеся в детском возрасте.
Вариант неопределенной клинической значимости (англ. variant of uncertain clinical significance, VUS) – вариант, отношение которого к фенотипу пациента не может быть достоверно установлено на момент анализа.
Неполная (сниженная) пенетрантность – явление, при котором патогенный генетический вариант проявляется фенотипически не у всех его носителей.
Вариабельная экспрессивность – различная степень выраженности клинических проявлений при носительстве одного и того же генетического варианта и/или синдрома.
Мультидисциплинарная команда (МК) — это группа специалистов из разных дисциплин или областей медицины, которые объединяются для совместной работы над общей целью или задачей.
Обсуждение клинической ситуации (ОКС) – обсуждение и принятие мультидисциплинарной командой решения в отношении включения в заключение вариантов, имеющих неоднозначную трактовку или не имеющих отношение к показаниям к проведению исследования, которые могут повлиять на тактику ведения беременности.
4. ПОКАЗАНИЯ ДЛЯ ПРОВЕДЕНИЯ ВЫСОКОПРОИЗВОДИТЕЛЬНОГО СЕКВЕНИРОВАНИЯ И МОЛЕКУЛЯРНОГО КАРИОТИПИРОВАНИЯ НА МИКРОМАТРИЦАХ В ПРЕНАТАЛЬНЫЙ ПЕРИОД
Обязательными условиями для проведения высокопроизводительного секвенирования и ХМА в пренатальный период являются наличие показаний для проведения исследования и подписание пациентом (законным представителем пациента) информированного согласия.
1. Показаниями для проведения высокопроизводительного секвенирования в пренатальный период являются:
1.1. наличие у плода специфического фенотипа или множественных аномалий развития, позволяющее предположить генетическую этиологию (с большей вероятностью моногенную);
1.2. отягощенный анамнез: наличие в семье плодов (или детей) с одной крупной или множественными аномалиями развития, предполагающими генетическую этиологию и повторный случай возникновения подобных аномалий при текущей беременности;
1.3. носительство супругами вариантов, которые могут приводить к моногенному заболеванию у ребенка, при невозможности их определения у плода другими методами.
2. Показаниями для ХМА в пренатальный период являются:
2.1. наличие у плода структурных аномалий, если с высокой вероятностью не предполагаются частые анеуплоидии, полиплоидии, а также конкретные генетические синдромы, определяемые другим методом (например, моногенная патология);
2.2. наличие у родителей установленных сбалансированных перестроек (зависит от конкретной перестройки);
2.3. подозрение на CNV по результатам НИПС/НИПТ;
2.4. наступление беременности в результате экстракорпорального оплодотворения, в случае переноса мозаичного эмбриона;
2.5. при подозрении на наличие у плода частых анеуплоидий (по данным НИПС/НИПТ или пренатального скрининга) в качестве альтернативы другим методам (классическая цитогенетика, FISH, QF-PCR). Исключением является ситуация с подозрением на мозаицизм (в этом случае предпочтительным является FISH);
2.6. при нормальной анатомии плода ХМА может использоваться как альтернатива другим методам определения кариотипа;
2.7. ХМА может использоваться как дополнительное исследование, если при определении кариотипа плода с врожденными пороками развития другими методами не было выявлено патологии. В случае, если у плода предполагается моногенная патология, для которой при использовании полноэкзомного секвенирования или панели генов не была выявлена причина фенотипа, возможно использование ХМА;
2.8. ХМА может использоваться для уточнения результатов, полученных другими методами (например, при выявлении сверхчисленной маркерной хромосомы при стандартном кариотипировании; при подозрении на наличие CNV по результатам анализа экзомных данных и т.п.).
5. ОБЛАСТИ ПРИМЕНЕНИЯ РЕЗУЛЬТАТОВ ВЫСОКОПРОИЗВОДИТЕЛЬНОГО СЕКВЕНИРОВАНИЯ И МОЛЕКУЛЯРНОГО КАРИОТИПИРОВАНИЯ НА МИКРОМАТРИЦАХ
1. Областью применения результатов высокопроизводительного секвенирования является:
1.1. изменение тактики ведения текущей беременности и/или новорожденного в неонатальном периоде при выявлении/невыявлении у плода вариантов нуклеотидной последовательности (SNV, коротких инсерций и делеций, CNV и пр.), вероятно приводящих к проявлению генетических заболеваний;
1.2. определение риска повторения для следующих беременностей и тактики проведения дородовой диагностики в будущем (после завершения беременности, при повторном планировании деторождения в семье).
2. Областью применения результатов ХМА является:
2.1. изменение тактики ведения текущей беременности и/или новорожденного в неонатальном периоде при выявлении/невыявлении у плода хромосомных анеуплоидий, включая частичные анеуплоидии, при наличии у плода несбалансированных хромосомных перестроек, микроделеций и микродупликаций, полиплоидии (в случае выявления), клинически значимых участков потери гетерозиготности;
2.2. определение риска повторения для следующих беременностей и тактики проведения дородовой диагностики в будущем (после завершения беременности, при повторном планировании деторождения в семье).
6. ОРГАНИЗАЦИЯ РАБОТЫ МУЛЬТИДИСЦИПЛИНАРНОЙ КОМАНДЫ
1. Целью работы МК является принятие решения в отношении включения в заключение вариантов, имеющих неоднозначную трактовку или не имеющих отношение к показаниям к проведению исследования, которые могут повлиять на тактику ведения беременности.
2. В состав МК могут входить:
- сотрудники лаборатории (врач-генетик, врач-лабораторный генетик, биолог, клинический биоинформатик, научные сотрудники);
- направивший врач (врач-генетик);
- ведущий беременность врач (акушер-гинеколог);
- врачи других специальностей, при необходимости.
Решение о включении или не включении вариантов в заключение принимается в рамках ОКС.
При наличии возможности рекомендуется включать в состав МК сотрудника лаборатории, участвующего в интерпретации данных, и направившего врача. Создание МК может быть инициировано как лабораторией, так и лечащим врачом. Лаборатория, участвующая в диагностике в пренатальном периоде, должна быть готова принимать участие в ОКС.
7. УСЛОВИЯ ПОЛНОЙ И КАЧЕСТВЕННОЙ ИНТЕРПРЕТАЦИИ РЕЗУЛЬТАТОВ ВЫСОКОПРОИЗВОДИТЕЛЬНОГО СЕКВЕНИРОВАНИЯ И МОЛЕКУЛЯРНОГО КАРИОТИПИРОВАНИЯ НА МИКРОМАТРИЦАХ
1. Полнота и качество интерпретации результатов высокопроизводительного секвенирования и ХМА способствуют определению клинически обоснованной тактики ведения текущей беременности, будущего новорожденного, а также оценке рисков повторения при следующих беременностях и возможности проведения дородовой диагностики в будущем.
2. Для обеспечения полноты и качества интерпретации результатов высокопроизводительного секвенирования и молекулярного кариотипирования на микроматрицах необходимо одновременное соблюдение следующих условий:
2.1. наличие показаний к проведению исследования (могут включать предполагаемый диагноз при наличии);
2.2. подробное описание причины направления (клинических показаний) и клинической картины у плода, семейного анамнеза (при наличии);
2.3. возможность проведения дополнительного (повторного) анализа данных в течение беременности и/или постнатально при изменении или уточнении клинической картины (по направлению врача). Для обеспечения возможности повторного анализа лаборатории рекомендуется хранить данные в течение года, а также предлагать пациентам получить первичные данные (для обеспечения возможности повторного анализа после истечения срока хранения их в лаборатории или независимого анализа в другой лаборатории);
2.4. возможность получения актуальной информации о статусе беременности и состоянии плода;
2.5. доступность материала обоих генетических родителей (для обеспечения возможности одновременного исследования плода и родителей и/или дополнительных исследований);
2.6. возможность, при необходимости, проведения дополнительных (в том числе подтверждающих) исследований плоду и/или родителям другими методами.
3. При интерпретации результатов высокопроизводительного секвенирования и молекулярного кариотипирования на микроматрицах необходимо учитывать возможность выявления случайных и вторичных находок, а также вариантов неопределенной клинической значимости.
4. Принятие решений о необходимости включения в заключение некоторых категорий находок рекомендуется проводить в рамках ОКС.
8. СЛОЖНОСТИ АНАЛИЗА И ИНТЕРПРЕТАЦИИ ДАННЫХ, СПЕЦИФИЧНЫЕ ДЛЯ ПРЕНАТАЛЬНОГО ПЕРИОДА
1. При проведении анализа во время продолжающейся беременности полученная информация, в том числе о случайных и вторичных находках, вариантах (SNV, короткие инсерции и делеции, CNV и др.) неопределенной клинической значимости, может влиять на решения о ведении и пролонгировании беременности и быть источником тревожности для беременной женщины (родителей), что обусловливает требования к срокам проведения исследования и уровню значимости вариантов, которые выносятся в заключение.
2. Данные о пренатальном фенотипе в основном ограничены структурными изменениями у плода. Выявление структурных изменений может быть затруднено в связи с ранним сроком гестации, а также особенностями и ограничениями визуализации.
3. Несоответствие пренатального фенотипа постнатальному. Данные о пренатальном фенотипическом спектре многих заболеваний ограничены.
4. Необходимость учитывать сроки выполнения исследования, в т.ч. время интерпретации данных, связанных с течением беременности.
5. Особенности биологических материалов: возможность наличия плацентарного мозаицизма в материале, полученном при биопсии хориона.
6. Возможность контаминации материнской ДНК любого материала плода, получаемого при инвазивной диагностике, требует обязательного контроля наличия контаминации при проведении исследования.
7. Необходимость дополнительных исследований. В ряде случаев требуются дополнительные исследования как самого плода (например, ультразвуковое исследование для уточнения соответствия фенотипа выявленным вариантам), так и его родителей (в некоторых случаях и других родственников), для уточнения статуса de novo или сегрегации выявленных вариантов в семье. Могут быть рекомендованы и другие исследования в зависимости от находки.
8. Потенциальная значимость полученной при исследовании информации не только для исследуемого плода. Выявленные в ходе исследования варианты могут иметь значение для планирования последующих беременностей, а также для здоровья других членов семьи. В свете проблемы п. 1 такая информация, при наличии соответствующего информирования и консультирования, может быть сообщена после завершения беременности. Уточнение этой информации может также потребовать дополнительных исследований других членов семьи.
9. Полученная в ходе анализа информация о том, что один из родителей не является генетическим родителем плода, может критически повлиять на качество выполняемого анализа (при отсутствии материала обоих биологических родителей невозможно уточнение происхождения вариантов для их достоверной интерпретации). Возможность выполнения в этом случае анализа не в полном объеме, а также вероятность получения информации о том, что один из родителей не является генетическим родителем, должна быть отражена в информированном согласии.
9. ПОРЯДОК ФОРМИРОВАНИЯ ЗАКЛЮЧЕНИЯ ПРИ АНАЛИЗЕ РЕЗУЛЬТАТОВ ВЫСОКОПРОИЗВОДИТЕЛЬНОГО СЕКВЕНИРОВАНИЯ И МОЛЕКУЛЯРНОГО КАРИОТИПИРОВАНИЯ НА МИКРОМАТРИЦАХ В ПРЕНАТАЛЬНОМ ПЕРИОДЕ
1. Порядок формирования заключения должен быть установлен до начала проведения анализа. Следует отметить, что порядок формирования заключения относительно части находок зависит от того, когда выдается заключение – во время беременности или после ее завершения.
2. Рекомендуется анализировать и включать в заключение во время продолжающейся беременности только патогенные или вероятно патогенные варианты, связанные с причиной исследования, анеуплоидии и полиплоидии (в случае выявления). При необходимости возможно проведение дополнительного анализа после завершения беременности. Информация о порядке формирования заключения по итогам анализа должна быть отражена в информированном согласии.
3. Любой вариант, включенный в заключение, должен быть проинтерпретирован согласно руководству по интерпретации данных МПС с указанием степени патогенности.
4. Не рекомендуется включать в заключение доброкачественные и вероятно доброкачественные варианты, выявленные как при проведении высокопроизводительного секвенирования, так и при ХМА.
5. Не рекомендуется во время продолжающейся беременности анализировать варианты неопределенной клинической значимости, не связанные с причиной исследования.
6. Не рекомендуется во время продолжающейся беременности анализировать гетерозиготные патогенные и вероятно патогенные варианты, не связанные с причиной исследования и ассоциированные с рецессивной патологией (не приводящие к развитию тяжелой клинической картины без второго патогенного варианта), при невыявлении второго варианта.
7. Во время продолжающейся беременности включение в заключение гетерозиготных патогенных и вероятно патогенных вариантов в генах, ассоциированных с аутосомно-рецессивной патологией, при невыявлении второго варианта, которые связаны с показанием к проведению исследования, допустимо только по результатам ОКС при наличии возможности уточнения их значимости, информация об этом должна быть отражена в информированном согласии.
8. Не рекомендуется анализ патогенных и вероятно патогенных вариантов, не связанных с причиной исследования и при этом имеющих неполную пенетрантность, во время продолжающейся беременности. Анализ и включение в заключение таких вариантов возможны после завершения беременности в зависимости от подписанного информированного согласия. При этом в заключении необходимо указывать информацию о неполной пенетрантности варианта и/или вариабельной экспрессивности заболевания.
9. Не рекомендуется анализ вариантов в генах неопределенной клинической значимости (GUS), выявленных при проведении высокопроизводительного секвенирования, до завершения беременности. Любой вариант в GUS не может быть проинтерпретирован выше, чем VUS, независимо от применяемых критериев патогенности. Порядок анализа и включения в заключение таких вариантов после завершения беременности должен устанавливаться до начала проведения анализа и быть отражен в информированном согласии.
10. Не рекомендуется анализ вторичных патогенных или вероятно патогенных находок у плода, в том числе в генах, отвечающих за поддающиеся лечению или профилактике моногенные заболевания, во время продолжающейся беременности, поскольку потенциально такая информация может косвенно влиять на решение о пролонгировании или прерывании беременности. Эта информация может быть проанализирована после завершения беременности при наличии информированного согласия.
11. Анализ и включение в заключение во время продолжающейся беременности вариантов с неопределенной клинической значимостью, выявленных при проведении высокопроизводительного секвенирования или ХМА, вероятно имеющих отношение к причине исследования, возможны по результатам ОКС. При принятии решения о включении в заключение таких вариантов следует обратить внимание на возможность уточнения их значимости: во время текущей беременности не рекомендуется выдача вариантов, для которых отсутствует возможность уточнения значимости по результатам дополнительных исследований. Следует учитывать возможное влияние этой информации на принимаемые решения по пролонгированию или прерыванию беременности. Информация об этом должна быть отражена в информированном согласии.
12. Анализ и включение в заключение во время продолжающейся беременности случайных находок не рекомендуется, но возможен по результатам ОКС. Анализ и включение в заключение таких вариантов возможны после завершения беременности в зависимости от подписанного информированного согласия.
13. Во время продолжающейся беременности не рекомендован анализ носительства патогенных и вероятно патогенных вариантов, ассоциированных с Х-сцепленной патологией у плода. После завершения беременности включение в заключение таких вариантов возможно только по результатам ОКС при наличии соответствующего информированного согласия.
14. При выдаче вариантов, выявленных при проведении секвенирования панелей генов, полного экзома и полного генома, стоит учитывать, что не для всех моногенных заболеваний хорошо описаны фенотипические проявления пренатально (например, несиндромальный интеллектуальный дефицит или наследственные болезни обмена). Независимо от уровня патогенности вариантов, анализ вариантов, ассоциированных с заболеваниями с поздним началом (во взрослом возрасте), во время продолжающейся беременности не рекомендован.
15. Не рекомендуется рутинный анализ дополнительной информации по родителям при одновременном исследовании родителей и плода до завершения беременности. Возможность выдачи таких вариантов должна быть обсуждена на претестовом консультировании и отражена в информированном согласии, поскольку при сообщении дополнительных находок у родителей возникает вопрос о наличии их у плода. В этом случае может быть целесообразно проведение повторного анализа или выдача расширенного варианта заключения после завершения беременности.
16. Важно отметить, что семья имеет право отказаться от получения информации о находках, всей или части, прямо не относящихся к причине проведения исследования, как у плода, так и у родителей. Это должно быть детально отражено в информированном согласии.
17. Рекомендуется проведение дополнительного анализа данных в течение беременности и/или постнатально при изменении или уточнении клинической картины, эти рекомендации должны быть отражены в заключении. При анализе результатов секвенирования образцов, полученных пренатально, следует учитывать, что наблюдаемый пренатально фенотип может не соответствовать постнатальному и может существенно меняться в течение беременности, что усложняет интерпретацию обнаруженных вариантов.
18. Рекомендуется фиксировать информацию о вторичных и случайных находках, а также о вариантах неопределенной значимости, которые были обнаружены, но не анализировались в связи с положениями информированного согласия и не были включены в заключение в связи с продолжающейся беременностью, во внутренней базе данных.
19. Все особенности формирования заключения, описанные в пп. 2–17, должны быть отражены в информированном добровольном согласии, утвержденном организацией, выполняющей генетические исследования. Пример формы информированного добровольного согласия представлен в приложении 1.
10. ОСОБЕННОСТИ И ОГРАНИЧЕНИЯ ИСПОЛЬЗОВАНИЯ ВЫСОКОПРОИЗВОДИТЕЛЬНОГО СЕКВЕНИРОВАНИЯ В ПРЕНАТАЛЬНЫЙ ПЕРИОД
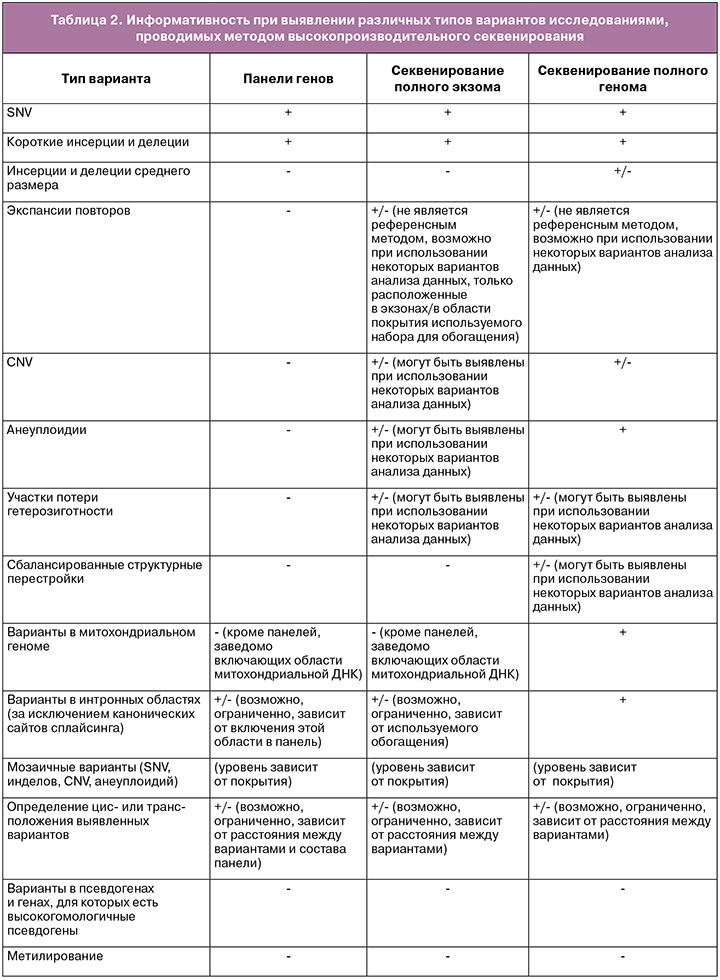
Для проведения пренатальной диагностики методом высокопроизводительного секвенирования возможно использование панелей генов, полноэкзомного и полногеномного секвенирования. Каждый из перечисленных методов исследования имеет свои преимущества и недостатки (табл. 1). Важно отметить, что перечисленные ограничения касаются секвенирования с короткими прочтениями длиной до 250 п.н. В настоящих методических рекомендациях не рассматриваются особенности и ограничения секвенирования с длинными прочтениями.
Высокопроизводительное секвенирование имеет ряд ограничений (табл. 2), для всех вариантов исследования невозможна оценка уровня метилирования, затруднен анализ вариации длины повторов (в том числе экспансии коротких нуклеотидных повторов) и детекция вариантов в областях псевдогенов. Определение цис- или транс-положения пар гетерозиготных вариантов зависит от расстояния между ними. Выявление вариантов в состоянии мозаицизма может быть ограничено и зависит от технических характеристик проводимого исследования (глубины покрытия).
При проведении полноэкзомного или полногеномного исследования возможно выявление участков потери гетерозиготности, но оно зависит от возможностей лаборатории.
Полноэкзомное секвенирование и панели генов не предназначены для поиска вариантов в митохондриальном геноме за исключением случаев, когда обогащение включает митохондриальный геном. Панели генов не предназначены для выявления любых хромосомных перестроек.
Полноэкзомное секвенирование не позволяет достоверно выявлять инсерции и делеции большого размера (размер зависит от используемой методики), не гарантирует выявление вариантов в интронных областях (за исключением канонических сайтов сплайсинга).
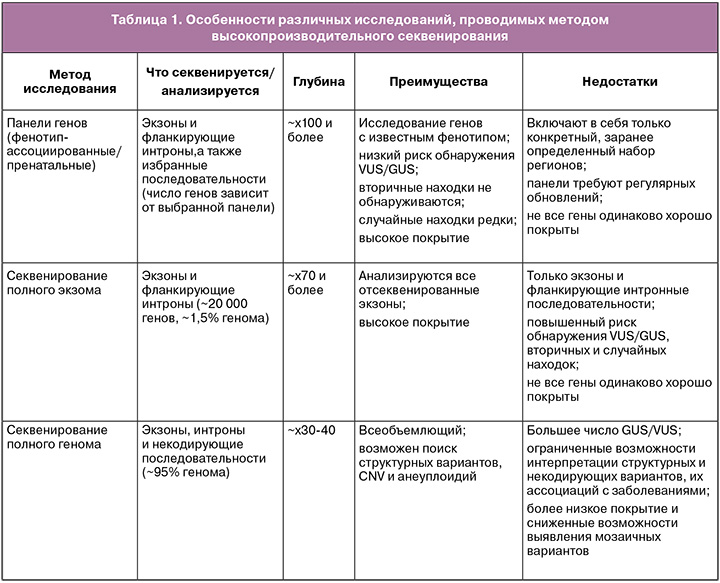
Полногеномное секвенирование имеет ряд ограничений при выявлении сбалансированных транслокаций.
При совместном исследовании плода и членов семьи необходимо убедиться, что родственникам плода не делались пересадка костного мозга и/или переливание крови течение полугода перед исследованием, иначе необходимо брать в исследование ДНК/РНК, выделенную из другого биологического материала, например, из буккального эпителия.
11. ОСОБЕННОСТИ И ОГРАНИЧЕНИЯ ИСПОЛЬЗОВАНИЯ МОЛЕКУЛЯРНОГО КАРИОТИПИРОВАНИЯ НА МИКРОМАТРИЦАХ В ПРЕНАТАЛЬНЫЙ ПЕРИОД
ХМА используется для проведения молекулярного кариотипирования.
Существует два принципиальных типа используемых матриц – aCGH (сравнительная геномная гибридизация) и SNP (с использованием однонуклеотидных полиморфизмов). Оба эти типа позволяют определить CNV, но SNP-матрицы также – участки потери гетерозиготности и большинство полиплоидий (за исключением тетраплоидий с симметричным удвоением генетического материала). Также матрицы могут отличаться по расположению и количеству зондов, что приводит к отличиям в разрешающей способности, регионов, доступных для анализа.
Ограничения метода:
1. Невозможность обнаружения сбалансированных перестроек.
2. Ограниченная возможность определения полиплоидий – в зависимости от используемого типа микроматриц и характера полиплоидии.
3. Ограниченная возможность определения участков потери гетерозиготности в зависимости от используемого типа микроматриц (недоступно при использовании aCGH-матриц). При подозрении на наличие участков потери гетерозиготности в регионах, ассоциированных с болезнями импринтинга, могут быть назначены дополнительные исследования, например, анализ метилирования соответствующих участков.
4. Ограниченная возможность выявления низкоуровневого мозаицизма (доля зависит от размеров и расположения CNV, а также используемых матриц). При подозрении на мозаицизм при необходимости для его валидации и уточнения доли рекомендуется проведение исследования референсным методом (FISH).
5. Ограниченная возможность выявления в материале нескольких клонов клеток с различными кариотипами (например, смесь моносомных, нормальных и трисомных по отдельной хромосоме клеток). Подобные нарушения могут лабораторно определяться как мозаицизм или не выявляться (в зависимости от используемого типа матриц и/или соотношения клонов клеток). При подозрении на такие нарушения рекомендуется проведение исследования референсным методом.
6. Регионы определения CNV могут быть ограничены в зависимости от используемых матриц (расположение зондов, как правило, указано в описании производителя).
7. Размер определяемых CNV ограничен разрешающей способностью используемых матриц (как правило, указано в описании производителя).
8. Большинство микроматриц, используемых для молекулярного кариотипирования, не предназначены для выявления однонуклеотидных вариантов и нарушений метилирования, поэтому варианты этих типов не могут быть обнаружены при выполнении этого вида анализа.
9. При выполнении ХМА определяется наличие CNV, но не механизм формирования выявленного дисбаланса (имеет значение для оценки генетического риска при следующих беременностях).
12. ОСОБЕННОСТИ МЕДИКО-ГЕНЕТИЧЕСКОГО КОНСУЛЬТИРОВАНИЯ И ИНФОРМИРОВАНИЯ ПАЦИЕНТОВ В РАМКАХ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ
При проведении медико-генетического консультирования необходимо соблюдение этических принципов: уважение достоинства и автономии пациента, недирективность медико-генетического консультирования, добровольность и информированное согласие пациентов на все процедуры, конфиденциальность информации о пациенте, полученной в процессе обследования.
При проведении пренатальной диагностики рекомендуется проведение как претестового, так и посттестового консультирования. Консультирование должно проводиться с участием врача-генетика.
Особенностью претестового консультирования в пренатальном периоде является необходимость разъяснения:
1. объема информации, которая анализируется в ходе исследования и включается в заключение;
2. возможности получения в ходе исследования дополнительной или неоднозначной информации, часть которой при этом может быть проанализирована и включена в заключение только после завершения беременности;
3. возможности назначения дополнительных исследований, в том числе не генетических, как для плода, так и для родителей (иногда – других родственников) для уточнения значимости полученной генетической информации в некоторых случаях;
4. возможности получения информации о том, что один из родителей не является генетическим родителем плода, при одновременном проведении исследования плоду и родителям.
Пациенту/пациентам должна быть предложена возможность отказаться от получения любой информации, не являющейся обязательной к выдаче.
Информация, обязательно включаемая в заключение при проведении пренатального ХМА или высокопроизводительного секвенирования, в случае ее выявления:
- патогенные и вероятно патогенные варианты, имеющие отношение к причине проведения исследования;
- анеуплоидии;
- полиплоидии (в случае выявления).
Информация том, что один из родителей не является генетическим родителем плода, может быть включена в заключение в случае, если она является клинически важной (например, отсутствие генетического родителя не позволяет уточнить значимость выявленного у плода варианта).
К информации, которая может быть включена или не включена в заключение в рамках текущей беременности или в любом периоде, в зависимости от согласия пациентов, могут относиться:
1. варианты неопределенной клинической значимости, имеющие отношение к причине проведения исследования (во время текущей беременности включаются в заключение при положительном решении МК; могут потребоваться дополнительные исследования; после завершения беременности – всегда);
2. случайные находки у плода (во время текущей беременности – при положительном решении МК в зависимости от подписанного информированного согласия, после завершения беременности – в зависимости от подписанного информированного согласия).
К информации, которая не анализируется в рамках текущей беременности, но может быть проанализирована при исследовании абортивного материала или в рамках повторного анализа и расширенного заключения после завершения беременности (при наличии соответствующего информированного согласия), могут относиться:
1. X-сцепленные носительства рецессивных вариантов у плодов женского пола (при положительном решении МК);
2. случайные находки у родителей;
3. вторичные находки у плода и/или родителей.
Эта информация должна быть отражена в информированном добровольном согласии, подписанном пациентом/пациентами (беременной женщиной/родителями) до начала исследования. В информированном добровольном согласии должно быть четко указано согласие или несогласие пациента/пациентов на получение информации. И согласие на то, что часть информации может быть проанализирована и включена в заключение только после завершения беременности.
Посттестовое консультирование требуется как в случае обнаружения у плода вариантов, объясняющих фенотипические особенности плода, так и в случае отсутствия находок. В случае обнаружения вариантов, объясняющих фенотипические особенности плода, рекомендуется обсудить:
1. степень уверенности в полученных результатах и дальнейшую тактику ведения беременности;
2. значение результатов для здоровья плода до рождения и после рождения, включая ограничения, связанные с пренатальным фенотипом;
3. возможность направления новорожденного к врачу, специализирующемуся на выявленном заболевании;
4. последующее наблюдение после рождения ребенка;
5. риск повторения, варианты дородовой диагностики и ведения будущих беременностей;
6. цели и желания родителей пациента (плода), варианты ведения беременности и послеродового периода.
В случае отсутствия находок следует обсудить:
1. возможность наличия генетического заболевания у плода, несмотря на отсутствие находок;
2. дополнительное тестирование в случае необходимости;
3. возможность повторного анализа данных после завершения беременности в случае выявления у плода или новорожденного дополнительных признаков, что повышает информативность повторного анализа;
4. дополнительное наблюдение и обследование новорожденного, в т.ч. врачом-генетиком.
Может потребоваться дополнительная консультация после получения расширенного заключения или результатов повторного анализа.
13. ОСОБЕННОСТИ СОСТАВЛЕНИЯ И ПОДПИСАНИЯ ИНФОРМИРОВАННОГО ДОБРОВОЛЬНОГО СОГЛАСИЯ ДЛЯ ПРЕНАТАЛЬНЫХ ИССЛЕДОВАНИЙ МЕТОДАМИ ВЫСОКОПРОИЗВОДИТЕЛЬНОГО СЕКВЕНИРОВАНИЯ И МОЛЕКУЛЯРНОГО КАРИОТИПИРОВАНИЯ НА МИКРОМАТРИЦАХ
Обязательным условием для проведения исследования является претестовое консультирование и подписанное информированное добровольного согласие на проведение исследования. Информированное добровольное согласие может представлять собой либо самостоятельный документ, либо являться частью общего информированного согласия.
1. Информированное добровольное согласие подписывается:
1.1. информированное добровольное согласие на исследование и получение информации по результатам исследования должно быть подписано каждым человеком (или его законным представителем), материал которого используется для исследования;
1.2. информированное добровольное согласие об исследовании плода и выдачу выявленных у него вариантов подписывает мать;
1.3. помимо исследуемых информированное добровольное согласие обязательно подписывается врачом, проводившим претестовое консультирование.
2. Информация, которая должна быть обязательно отражена в информированном добровольном согласии (может быть оформлено в одном или нескольких документах):
2.1. согласие на хранение биоматериала; сроки хранения биоматериала; цели использования биоматериала.
2.2. согласие на хранение первичных данных; сроки хранения первичных данных; предложение получить первичные данные вместе с результатами анализа (для возможности их повторного анализа после окончания срока хранения данных); описание способа и сроков получения первичных данных; указание на то, что при неполучении пациентом первичных данных на этих условиях в эти сроки повторный анализ этих данных в дальнейшем будет невозможен;
2.3. информация о том, что было проведено консультирование и в ходе него пациент имел возможность получить всю интересующую его (ее) информацию;
2.4. ограничения используемого метода (в том числе характерные для исследования пренатально) – в соответствии с методом, на исследование которым подписано согласие;
2.5. указание на то, что невыявление причины заболевания в ходе исследования не означает отсутствия генетической причины;
2.6. информацию о возможности и условиях повторного анализа данных и/или получения расширенного заключения после завершения текущей беременности;
2.7. список обязательно включаемых в заключение результатов;
2.8. список информации, анализ которой не проводится до завершения текущей беременности;
2.9. список опционально включаемых в заключение результатов с возможностью у пациента отказаться от получения таких результатов (с отдельными подписями на согласие/несогласие получения информации по отдельным группам находок; с указанием периода, в который проводится анализ каждой части информации – во время или после завершения беременности; с указанием на то, что в некоторых случаях находки из этих групп могут быть не выданы по решению лаборатории – например, для VUS);
2.10. указание о возможности получения в ходе исследования информации о том, что один из родителей не является генетическим родителем плода (при одновременном исследовании плода и родителей), а также о том, что в этом случае исследование не может быть выполнено в полном объеме;
2.11. информация о сроках проведения исследования;
2.12. указание о том, что могут потребоваться дополнительные исследования как плода, так и родственников для уточнения значимости выявленных вариантов.
2.13. согласие на использование полученной информации в деперсонифицированном виде в научных, учебных, статистических и других целях (в том числе при биобанкировании).
3. Информация, которая может быть включена в заключение по результатам исследования в разные сроки с указанием ограничений (какие варианты могут быть включены в заключение только с участием МК; какие варианты будут анализироваться только после завершения беременности в расширенном заключении). На согласие/несогласие с получением этой информации желательно получить отдельные подписи (от каждого человека, для которого проводится исследование, для каждого раздела информации, относящегося к исследуемому).
3.1. случайные находки у плода (до завершения беременности включаются в заключение только по результатам обсуждения МК; после завершения беременности – по желанию)
3.2. вторичные находки у плода (анализируются только после завершения беременности);
3.3. варианты неопределенной клинической значимости у плода, вероятно связанные с причиной направления на исследование (до завершения беременности включаются в заключение по результатам обсуждения МК);
3.4. X-сцепленные носительства рецессивных патогенных и вероятно патогенных вариантов у плодов женского пола (включаются в заключение по результатам обсуждения МК, анализируются только после завершения беременности);
3.5. случайные находки у родителей (анализируются только после завершения беременности);
3.6. вторичные находки у родителей (анализируются только после завершения беременности).
Пример формы информированного добровольного согласия представлен в приложении 1.





