Мастопатия, или фиброзно-кистозная болезнь (ФКБ) — наиболее частое заболевание молочных желез женщин репродуктивного возраста. Доказано, что ее пролиферативные формы являются фактором риска рака молочных желез [4]. В настоящее время не существует общепринятой тактики ведения больных данной патологией. Основой лечения заболевания является использование консервативных подходов, в том числе с применением гормональных средств: антиэстрогенов, антигонадотропинов, агонистов гонадолиберина, агонистов рецепторов дофамина, а также препаратов прогестерона. Применение препаратов прогестерона при ФКБ основано на данных о наличии относительного или абсолютного дефицита прогестерона у больных данной патологией [2, 3, 8]. Однако сведения о механизмах их влияния на ткани молочных желез являются немногочисленными и противоречивыми [9, 12, 18].
Целью исследования явилось изучение влияние микронизированного прогестерона на клинические проявления мастопатии, биометрические характеристики паренхимы и интенсивность кровообращения в молочных железах.
Материал и методы исследования
Для лечения ФКБ у 42 больных был применен микронизированный прогестерон (прожестожель, BESINS HEALTHCARE) в виде накожных аппликаций. Прогестерон был назначен во вторую фазу менструального цикла (с 16-го по 25-й день 2 раза/сут по 2,5 г), в течение 6 мес. Критериями включения в исследование были возраст 18–40 лет, индекс массы тела 18,5– 29,9 кг/м2, клинические (масталгия; неоднородность ткани молочных желез при физикальном обследовании) и ультразвуковые признаки ФКБ. Критериями исключения из исследования являлись подозрение или подтвержденный злокачественный процесс в молочной железе, беременность, послеродовой период, лактация, использование в течение последних 6 мес средств гормональной контрацепции и заместительной гормональной терапии, тяжелая экстрагенитальная патология, злокачественные новообразования.
При клиническом исследовании учитывали следующие жалобы со стороны молочных
желез: боль (масталгию), выделения из сосков и изменение консистенции молочных желез. Для
объективной характеристики интенсивности болевого синдрома использовали частоту масталгии; среднюю продолжительность масталгии в течение месяца, характер боли (распирающая,
ноющая, чувство тяжести, связь болевого синдрома с физической нагрузкой, интенсивность
масталгии, согласно визуально-аналоговой шкале: при этом считали, что пациентка испытывает боль легкой интенсивности при указании на отрезок от 1 до 3 см; боль средней интенсивности – от 4 до 7 см; сильную боль – от 7 см и более).
Ультразвуковое исследование (УЗИ) молочных желез проводили на диагностическом аппарате
«Aloka SSD-1700» с использованием линейного датчика с частотой 7,5–10 МГц. Осмотр производили в положении пациентки, лежа спиной на кушетке с поднятой и отведенной на стороне исследования рукой. Исследование осуществлялось на 5–7-й день менструального цикла. С целью количественного анализа изображения молочных желез осуществляли измерение толщины их паренхимы – фиброгландулярной зоны (ФГЗ) в области ее наибольшей выраженности, то есть в верхнем наружном квадранте молочной железы вдоль радиальной линии, разделяющей квадрант пополам и сходящейся к соску. Измерение осуществляли от наружного контура переднего до наружного контура заднего листка расщепленной фасции молочной железы. После определения толщины ФГЗ в правой и левой молочных железах, вычисляли ее среднюю величину.
Изучение кровообращения в молочной железе осуществляли с помощью допплерометрии кровотока в артериях паренхимы молочных желез с использованием цветного допплеровского картирования кровотока. Оценку кровотока в данных сосудах производили при помощи качественного анализа кривых скоростей кровотока (КСК). При качественном анализе использовали величины систоло-диастолического отношения (СДО), индекса резистентности (ИР) и пульсационного индекса (ПИ). После их определения вычисляли средние величины:
· ПИ – отношение разницы между максималь- ной систолической (А) и конечной диастолической (В) скоростями кровотока к средней скорости кровотока (М): ПИ=А—В/М.
· ИР – отношение разности максимальной систолической (А) и конечной диастолической скорости (В) к максимальной систолической скорости кровотока: ИР=А—В/А.
· СДО – отношение между максимальной систолической и конечной диастолической скоростями кровотока: СДО=А/В.
Динамический контроль клинической картины заболевания, ультразвуковых и допплерометрических показателей сопротивления кровотоку в паренхиматозных артериях ткани молочной железы осуществляли через 3 и 6 мес от начала терапии.
Результаты исследования
Частота возникновения масталгии у больных ФКБ при использовании микронизированного прогестерона снизилась через 3 мес в 2,5 раза (со 100 до 36%), а через 6 мес – в 3 раза (с 36 до 12%). При этом у всех пациенток боль, как и до начала терапии, наблюдалась во вторую фазу менструального цикла и носила циклический характер. Продолжительность масталгии сократилась в среднем через 3 мес терапии с 7,5±0,4 дня до 4,5±0,4 дня, а через 6 мес – до 3,6±0,2 дня. В характере масталгии при использовании прогестерона также произошли изменения. Так, если до начала лечения преобладала боль распирающего характера (44,3%), то через 3 мес лечения чувство распирания исчезло у всех пациенток. При этом большинство (30,9%) женщин испытывали чувство тяжести и только 4,8% – ноющую боль. Через 6 мес от начала трансдермального применения микронизированного прогестерона 11,9% больных мастопатией отмечали наличие только чувства тяжести. Боли распирающего характера и ноющие боли не наблюдались ни у одной из больных ФКБ.
До лечения болевой синдром большинство больных (62,1%) отмечали в покое. При этом у 37,9% пациенток боль возникала при физической нагрузке. Через 3 мес от начала применения микронизированного прогестерона трансдермально масталгия проявлялась только при физической нагрузке у 35,7% больных, боль в покое отсутствовала. После 6 мес терапии микронизированным прогестероном в виде накожных аппликаций боль беспокоила при физической нагрузке только 11,9% больных. Степень тяжести болевого синдрома в молочных железах до лечения и через 3 и 6 мес от начала терапии изображены на рис. 1.
Рисунок 1. Степень тяжести масталгии.
До лечения масталгия в половине случаев была умеренной степени выраженности, а каждая четвертая больная испытывала масталгию тяжелой степени. На фоне трансдермального лечения микронизированным прогестероном через 3 мес у 64% больных боли в молочных железах исчезли. Частота тяжелой степени масталгии сократилась с 25,3 до 2,3% (в 11 раз) (р<0,05), а умеренной
степени – с 54,4 до 4,8% (в 11 раз) (р<0,05). Через 6 мес лечения у 88% больных болевой синдром
отсутствовал. Только 9,5% пациенток испытывали масталгию легкой и 2,4% – умеренной степени выраженности. Тяжелая степень масталгии после 6 мес применения трансдермального прогестерона не наблюдалась.
Таблица. Качественные допплерометрические показатели сопротивления кровотоку в артериях
паренхимы молочных желез при трансдермальном применении микронизированного прогестерона
(M±m).
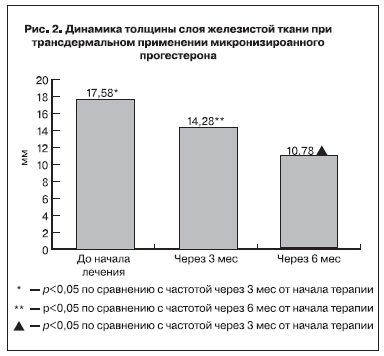
При выполнении УЗИ (рис. 2) через 3 мес использования микронизированного прогестерона трансдермально толщина железистого слоя составила 14,28±0,53 мм, что в 1,2 раза меньше, чем до начала терапии (р<0,05). Через 6 мес толщина железистого слоя уменьшилась до 10,78±0,47 мм, что в 1,3 раза меньше, чем при определении ФГЗ через 3 мес терапии (р<0,05). Диаметр млечных протоков уменьшился с 1,79±0,06 мм до 1,31±0,05 мм через 3 мес применения и до 1,14±0,04 мм (р<0,05) через 6 мес.
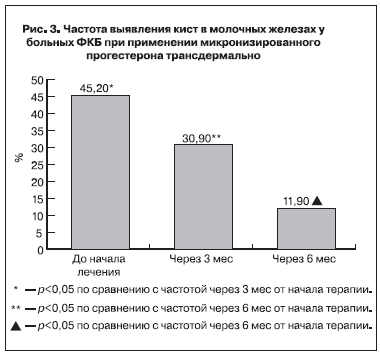
В группе больных, использовавших микронизированный прогестерон трансдермально, оказались 19 (45,2%) женщин с кистами до 10 мм в диаметре. Через 6 мес применения число больных с кистами уменьшилось до 11,9% (рис. 3).
Качественные допплерометрические показатели в группе женщин, получавших микронизированный прогестерон трансдермально, были оценены через 3 и 6 мес от начала терапии. Данные представлены в таблице. Через 3 мес лечения ПИ увеличился в 1,8 раза (с 0,80 до 1,44; р<0,001), а ИР – в 1,6 раза (с 0,46 до 0,76; р<0,001). Через 6 мес выявлено достоверное увеличение в 2 раза ПИ (с 0,80 до 1,64; р<0,001) и ИР (с 0,46 до 0,90; р<0,001), СДО – в 1,5 раза (с 2,89 до 4,39; р<0,05). Возрастание показателей сопротивления кровотоку в артериях паренхимы молочных желез свидетельствует о снижении интенсивности кровообращения в органе.
Обсуждение результатов
Трансдермальное применение прогестерона привело к снижению частоты, длительности, интенсивности и изменению характера боли в молочных железах. Причем наибольшие темпы изменения характеристик масталгии наблюдались в первые 3 мес от начала терапии. Изменение клинической картины заболевания сочеталось с существенными изменениями биометрических ультразвуковых показателей: уменьшением толщины железистого слоя молочных желез, числа кист, диаметра млечных протоков. Полученные результаты могут быть обусловлены влиянием прогестерона на пролиферативную активность клеток молочных желез. Так, J.-М. Foidart и соавт. (1998) in vivo показали, что локальное применение препаратов прогестерона приводит к снижению содержания в молочных железах маркера пролиферации – ядерного антигена пролиферирующих клеток (PCNA), а также митотического индекса [10]. Кроме этого, эффект прогестерона на клеточный цикл может определяться длительностью его воздействия и дозой [12]. В течение первых 12 ч воздействия прогестерон способен ускорить клеточный цикл, усиливая экспрессию ряда протоонкогенов, эпидермального фактора роста. Однако через 24–48 ч происходит остановка клеточного цикла и последующее введение прогестерона не приводит к его активации, пролонгируя состояние покоя клетки.
Изменение клинической картины мастопатии и биометрических характеристик паренхимы
молочных желез могли быть обусловлены также изменениями в интенсивности органного кровообращения на фоне применения прогестерона. Действительно, согласно результатам нашего
исследования, в течение 6 мес лечения происходит повышение сопротивления кровотоку в паренхиматозных артериях молочных желез. Это свидетельствует о снижении интенсивности органного кровообращения. В некоторых экспериментальных исследованиях показаны направления влияния прогестерона на сосудистый тонус. Так, M. White (1995) [18] выявил, что прогестерон, стимулируя продукцию эндотелием вазоактивных пептидов, может препятствовать вазодилатации. В ряде работ доказано, что стимуляция прогестероном тромбинзависимой вазоконстрикции способствует спазму сосудистой стенки, что достигается путем увеличения ее рецепторов к тромбину [11, 14]. Кроме этого есть сведения о возможном влиянии прогестерона на процесс васкулогенеза. Так, Т.А. Ботвич и соавт. (2007) [1] в работе на грызунах показали, что ежедневное введение 1% масляного раствора прогестерона в течение одного менструального цикла снижает активность Мg-АТФазы и приводит к уменьшению суммарной длины и диаметра капилляров в яичниках. Возможным механизмом изменения кровообращения в молочных железах под влиянием прогестерона является изменение локального синтеза эстрогенов в тканях молочных желез. Прогестерон стимулирует продукцию ферментов (17β-гидроксистероиддегидрогеназы и эстрон-сульфотрансферазы), которые окисляют эстрадиол в эстрон и затем, связывая последний, превращают его в неактивный эстрон-сульфат [17]. Тем самым снижается концентрация эстрадиола в тканях молочных желез. В экспериментальной работе на коронарных артериях V.M. Miller (1991) [13] было показано, что прогестерон способен ингибировать эстрадиолндуцируемую вазодилатацию.
Таким образом, применение микронизированного прогестерона (прожестожель) у больных мастопатией приводит к снижению выраженности клинической картины заболевания (снижению продолжительности, интенсивности и характера масталгии), изменению биометрических (уменьшение толщины паренхимы, числа кист, диаметра млечных протоков) и функциональных (гемодинамических) характеристик молочных желез.



