В настоящее время, благодаря широкому использованию и совершенствованию пренатальной ультразвуковой диагностики, наметилась тенденция к улучшению выявления аномалий развития плода, в частности пороков развития органов мочевыделительной системы, которые являются наиболее частыми среди врожденной патологии. Согласно данным литературы, их доля составляет до 36% всех пороков развития. В структуре пороков мочевыделительной системы различные варианты обструктивных уропатий наблюдаются в 40–87% [2, 24]; в 0,6–2,3% они диагностируются при беременности сроком 20–22 нед [23, 26].
Как известно, наиболее частой причиной развития данной патологии является нарушение
оттока мочи в чашечно-лоханочном, лоханочно-мочеточниковом, пузырно-мочеточниковом и пузырно-уретральном отделах мочевыводящих путей. Формирующиеся при этом анатомические особенности могут значительно различаться, что обусловлено степенью выраженности и уровнем обструкции. Так, в зависимости от последних, развиваются одностороннее или двустороннее поражения почек, дилатация чашечно-лоханочной системы, мочеточников, мочевого пузыря, уретры. Таким образом, их проявления могут варьироваться от пиелоэктазии до уретерогидронефроза с одной или двух сторон.
Прогноз при обструкции верхних отделов мочевыводящих путей, при отсутствии сочетанных аномалий, обычно благоприятный. В то же время при нарушении оттока мочи в нижних отделах мочевыводящих путей (атрезия или клапан уретры), прогноз в большинстве случаев неблагоприятный. Данное обстоятельство связано с тем, что наблюдаемое при этом двустороннее поражение почек сопровождается развитием у беременных выраженного маловодия, которое может привести к гипоплазии легких плода и деформации его конечностей. Наряду с формированием кистозной дисплазии почки с последующей потерей ее функции, в литературе представлены редкие случаи
спонтанного разрешения обструкции [6].
Далеко не всегда расширение лоханки и мочеточника связано с обструкцией мочевыводящих путей. В подобных ситуациях причинами возникновения данной патологии могут явиться пузырно-мочеточниковый рефлюкс, синдром Прун-Белли и нерефлюксирующий необструкционный мегауретер.
Прогноз для жизни новорожденных при обструктивных уропатиях определяют не только анатомо-функциональные особенности, сопровождающие порок, но и срок беременности, при котором он был впервые выявлен [24].
Цель исследования состояла в определении значения пренатальной эхографии в выявлении врожденных обструктивных уропатий у плода и тактики ведения беременности.
Материал и методы исследования
В основу работы положен ретроспективный анализ результатов обследования 109 новорожденных с выявленными в антенатальном периоде обструктивными аномалиями мочевыделительной системы, находившихся на лечении в отделении хирургии и интенсивной терапии новорожденных ФГБУ НЦ АГиП им. академика В.И. Кулакова в период с 2005 по 2010 г. Для получения объективных данных дородовая диагностика осуществлялась двумя независимыми специалистами ультразвуковой диагностики отделения функциональной диагностики Центра. Использовались ультразвуковые сканнеры Aloka-10 (Aloka, Япония) с трансабдоминальным конвексным датчиком с частотой 3,5 МГц и Aplio XG (Toshiba, Япония) с трансабдоминальным конвексным мультичастотным датчиком (3,5–6,0 МГц).
Эхографические исследования новорожденных производили в стационаре в течение первых 3 дней после рождения и перед выпиской, а также в амбулаторных условиях в 1-й, 3, 6 и 12-й месяцы. Согласно классификации, предложенной Обществом неонатальных урологов [5], в зависимости от степени выраженности обструкции мочевыводящих путей, установленной при ультразвуковом исследовании после рождения, все новорожденные были разделены на 4 группы: 1-ю группу составили новорожденные с отсутствием расширения лоханок и чашечек; 2-ю – с пиелоэктазией (лоханка расширена, чашечки не расширены), 3-ю – с гидронефрозом (расширение лоханки и чашечек) и 4-ю – с уретерогидронефрозом (расширение лоханки, чашечек и мочеточника).
В комплекс обследования новорожденных входили следующие исследования: клинический анализ крови, биохимический анализ крови и мочи, бактериологический анализ мочи, магнитно-резонансная томография (МРТ) мочевыделительной системы с контрастированием. Цистоуретрографию применяли для исключения пузырно-мочеточникового рефлюкса. Для оценки функции почек использовали определение биохимического профиля азотистого обмена (уровней мочевины, креатинина), допплерографическую картину состояния кровотока в почке, количественные показатели функции почек, по данным нефросцинтиографии и МР-урографии.
Показаниями для проведения оперативного лечения в период новорожденности служили: наличие на месте нефункционирующего органа объемного образования больших размеров, отсутствие функции пораженной почки (по данным ренографии или контрастного МРТ), признаки снижения функции почки (при наличии обструкции на уровне пиелоуретрального или уретеровезикального отдела мочеточника).
В зависимости от степени увеличения переднезаднего размера лоханки (ПЗРЛ) в III триместре беременности все пациенты были выделены в следующие группы: I группа – незначительное
расширение (до 9 мм), II группа – умеренное (от 9 до 15 мм) и III группа – выраженное расширение
(более 15 мм). В исследование были включены 93 новорожденных с одно- или двусторонним
увеличением ПЗРЛ почки более 7 мм, выявленным при ультразвуковом исследовании в III триместре беременности и подтвержденным после их
рождения (табл. 1).
Таблица 1. Распределение плодов и новорожденных в зависимости от степени увеличения ПЗРЛ.
Полученные данные были обработаны методами описательной статистики и представлены в виде среднего±стандартного отклонения и обработаны с использованием программ Excel (Microsoft Office 2007) и Statistica 6 (StatSoft). Математические методы обработки данных включали статистический и корреляционный анализы. Для определения значимости различий сопоставляемых величин использовали Kruskal Wallis ANOVA тест и χ2-тест. За уровень статистической достоверности было принято p<0,05.
Результаты исследования
В результате ретроспективного анализа установлено, что у 16 (14,6%) из 109 новорожденных, с
внутриутробно выявленным увеличением ПЗРЛ после рождения патология мочевыделительной системы не была подтверждена. Кроме того, у других 17 (15,6%) из 109 расширение чашечно-лоханочного комплекса разрешилось в течение 1-го мес жизни. Таким образом, спонтанное уменьшение ПЗРЛ при незначительной степени расширения чашечно-лоханочного комплекса произошло у 33 (30,3%) новорожденных, то есть в каждом третьем случае. В этой группе ПЗРЛ, измеренный антенатально, варьировался от 7 до 14 мм (в среднем 10,2±2,9 мм). У остальных 69,7% новорожденных спонтанного уменьшения ПЗРЛ не отмечено.
Дальнейшему детальному анализу подверглись результаты обследования 93 плодов (со 185 измененными почками), при этом одностороннее поражение почки было констатировано у 57,
двустороннее – у 36. При одностороннем поражении в 1,5 раза чаще наблюдалось расширение лоханки левой почки (28 против 19). Почти вдвое чаще (61 против 32) выявлялось поражение почек у плодов мужского пола. У 68 (73,1%) из 93 новорожденных выявлено одностороннее, у 25 (26,9%) – двустороннее поражение почек. Согласно рекомендациям Общества неонатальных урологов [5], все почки новорожденных (185) были разделены на группы в зависимости от степени выраженности обструкции мочевыводящих путей: в 1-ю группу (норма) вошли 64 (35%), во 2-ю – 26 (14%) с пиелоэктазией, в 3-ю – 54 (29%) с гидронефрозом и в 4-ю – 41 (22%) с уретерогидронефрозом. На рис. 1 представлено распределение этих групп в зависимости от средних значений ПЗРЛ почек в антенатальном периоде (рис. 1).
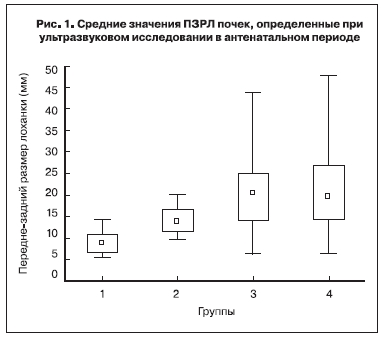
Указанные средние показатели ПЗРЛ достоверно различались (p<0,001): в 1-й группе они составили 9,1 мм (6–14 мм), во 2-й – 14,2 мм (10–20 мм), в 3-й – 20,6 мм (8–44 мм), в 4-й – 19,9 мм (8–48 мм). Однако значимой разницы в отношении ПЗРЛ почек между 3-й и 4-й группами не установлено (p=0,573).
При анализе причин расширения мочевыводящих путей наиболее частыми явились обструкция на уровне лоханочно-мочеточникового – 45 (41,4%) и пузырно-мочеточникового сегментов – 33 (30,8%). К другим причинам относились: пузырно-мочеточниковый рефлюкс – 6 (5,5%), клапан уретры – 2 (1,8%), уретероцеле – 1 (0,9%), нерефлюксирующий мегауретер – 8 (7,4%), удвоение почки – 9 (8,2%), а также сочетанные пороки развития – 5 (4,5%) (табл. 2). В постнатальном периоде 32 (34,4%) новорожденным потребовалось оперативное вмешательство: пластика пиелоуретерального сегмента – у 12, уретеронеоцистоимплантация – у 10, геминефруретерэктомия – у 5, нефростомия – у 2, нефроуретерэктомия – у 1, иссечение поперечной перегородки влагалища – у 1, рассечение цистоцеле – у 1 новорожденного. Все операции были выполнены в раннем неонатальном периоде (1–15 сут), средний возраст новорожденных на момент вмешательства составил 7,3±4,1 сут.
Таблица 2. Спектр аномалий развития диагностированных у 109 плодов с признаками обструкции мочевыводящих путей.
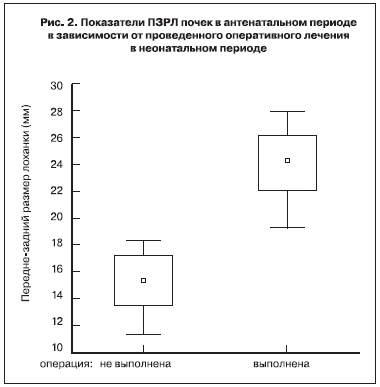
Выраженное расширение ПЗРЛ почек (24,8±4,7 мм) имелось у большинства оперированных детей (87,5%), умеренное (14,3±3,8 мм) наблюдалось лишь у 4 (12,5%). При сравнении ПЗРЛ почек новорожденных, у которых операция была выполнена и которым она не производилась, выявлено существенное различие этих показателей. Как показал ретроспективный анализ результатов клинико-инструментального обследования новорожденных, наиболее часто оперативные вмешательства выполнялись детям, ПЗРЛ почек которых превышал 19 мм при эхографическом исследовании, произведенном в III триместре беременности (p<0,001) (рис. 2).
Пузырно-мочеточниковый рефлюкс при цистографии был выявлен у 9 из 58 новорожденных, при этом двусторонний – у одного и односторонний – у 8. Первая степень выраженности рефлюкса установлена у 1 новорожденного, II – у 4, III –у 2, IV – у 2. Необходимо отметить, что частота его выявления преобладала у мальчиков (8) по сравнению с таковой у девочек (1).
Обсуждение
Бурное развитие технического обеспечения ультразвуковых приборов, связанное с разработкой новых датчиков и компьютерных технологий, существенно изменило качество дородового эхографического исследования. Вместо простой констатации наличия аномалий развития плода, в настоящее время появились возможности более тонкой детализации особенностей и топической диагностики пороков развития, что имеет большое прогностическое значение и во многом определяет тактику ведения беременности. Не вызывает сомнений тот факт, что антенатальное выявление аномалий мочевыделительной системы значительно облегчает диагностику данной патологии в постнатальном периоде, а также способствует снижению рисков развития осложнений у новорожденных [1, 19].
Крайне актуальным вопросом при врожденных обструктивных уропатиях является необходимость определить, в каких случаях поражение почки будет прогрессировать, в каких стабилизируется, а в каких подвергнется обратному развитию. Однако установление степени выраженности обструкции у плода и у новорожденного нередко вызывает значительные сложности. Таким образом, определение тактики ведения беременных с обструктивными уропатиями у плода до сих пор является предметом дискуссий. Так, S.A. Koff и P.A. Peller [12] предложили измерять размеры почек с момента выявления
гидронефроза с периодичностью 1 раз в 2 нед и до момента родов. По данным авторов, при выраженном гидронефрозе происходит компенсаторное увеличение размеров коллатеральной
«здоровой почки». В то же время R. Mallek и соавт. [16], J.M. Palmer и M. DiSandro [20] для дифференциальной диагностики обструктивного и необструктивного гидронефроза предложили использовать допплерометрию. Согласно полученным ими результатам, с помощью цветового допплеровского картирования может быть определен ток мочи, что подтвердит отсутствие обструкции. Вместе с тем данные методы не позволяют определить причину гидронефроза и не
являются предикторами последующей необходимости хирургического вмешательства [20, 25].
В настоящее время имеется много работ, посвященных оценке функции почек у плода, однако параметры, наиболее полно отражающие функцию почек, отсутствуют [7]. Для определения состояния почек плода могут также быть использованы и иные методы, включая анализ мочи, плазмы, амниотической жидкости и даже биопсию пораженной почки [10, 17]. Повышение концентраций натрия более 100 мэкв/л, хлора более 90 мэкв/л и осмолярности более 210 мосм/л в моче плода в сроке беременности до 20 нед связывают с неблагоприятным прогнозом [3, 18]. Таким образом, сохраняется необходимость поиска наиболее точных методов оценки состояния почек при обструктивных уропатиях.
Одним из этапов нашего исследования явилась разработка прогностического фактора, определяющего тяжесть патологии почек, который мог быть установлен до появления клинических
проявлений (осложнений). В качестве такого параметра был выбран ПЗРЛ почки. По данным литературы, измерение ПЗРЛ почки плода с помощью эхографии является наиболее ценным параметром для выявления пациентов, за которыми необходимо тщательное динамическое наблюдение [4]. Однако и в настоящее время нет единого мнения, какое расширение лоханки
считать «значительным» и кто из пациентов требует дальнейшего обследования после рождения. За пороговое значение в III триместре нами было принято расширение у плода ПЗРЛ более 7 мм, cогласно рекомендации в литературе [9, 15]. J.G. Ouzounian и соавт. [19] показали, что ПЗРЛ у плода 8 мм соответствует наилучшему сочетанию чувствительности и специфичности, 91 и 72% соответственно. По нашим результатам, увеличение ПЗРЛ у плода в III триместре более 10 мм с высокой вероятностью остается и после рождения (p<0,001). Нами также было установлено, что ПЗРЛ почки у плодов в III триместре беременности существенно не отличался от такового у новорожденных. При этом средние показатели ПЗРЛ достоверно различались в зависимости от степени выраженности обструкции (p<0,001). Исключением явились группы с каликопиелоэктазией и уретерокаликопиелоэктазией (p=0,573). При ультразвуковом исследовании плода и новорожденного отличительным признаком уретерокаликопиелоэктазии является изображение расширенного мочеточника, а не изменение ПЗРЛ почек, что совпадает с данными литературы [15].
Следует отметить, что тактика ведения беременности при врожденном гидронефрозе в последнее десятилетие изменилась: от наблюдения за прогрессированием поражения почки до внутриутробных вмешательств [24]. Выжидательная тактика основана на наблюдениях, согласно которым при незначительном расширении ПЗРЛ происходит ее спонтанное разрешение без изменения функции почки. По данным S.A. Koff [13],у 85% пациентов с антенатально выявленным увеличением ПЗРЛ при спонтанном улучшении перед родами или в раннем неонатальном периоде последующего хирургического вмешательства не требовалось. L.J. Harding и соавт. [8] сообщили, что при ПЗРЛ менее 10 мм у 43,1% новорожденных после рождения патология разрешается спонтанно. P.G. Ransley и соавтр. [22] указывают, что у новорожденных с сохраненной функцией почки более 40% и увеличением ПЗРЛ менее 1,2 см изменения почек подвергаются спонтанной регрессии и не требуют хирургического вмешательства. Приведенные выше исследования свидетельствуют о том, что при незначительном и умеренном увеличении ПЗРЛ почки необходимость в его хирургической коррекции низкая.
Согласно данным литературы, частота оперативных вмешательств у новорожденных с выраженным увеличением ПЗРЛ варьируется в пределах 7–40% и имеет устойчивую тенденцию к росту [21, 25]. По данным S. Sairam и соавт. [23], среди 75 новорожденных с обструктивными уропатиями оперативное вмешательство потребовалось 11 (15%). В нашем исследовании оперативное лечение было выполнено у существенно бóльшего контингента новорожденных, а именно у 32 (34,4%) из 109. На первый взгляд результаты проведенного нами анализа показывают, что частота спонтанного уменьшения ПЗРЛ ниже (30,3%), в то время как частота операции выше (34,4%) по сравнению с данными,приведенными в указанных выше публикациях. Подобная разница может быть объяснена тем, что в нашем исследовании новорожденные, у которых обструкция мочевыводящих путей не была выявлена после
рождения, были исключены из дальнейшего анализа. Согласно S. Sairam и соавт. [23], самопроизвольное уменьшение ПЗРЛ в антенатальном и раннем неонатальном периодах происходит у
88% плодов.
Кроме того, новорожденные с такими аномалиями, как клапан уретры, удвоение почки, уретероцеле и другими, были также включены в проводимый нами анализ, что значительно увеличило частоту хирургических вмешательств. ФГБУ НЦ АГиП им. академика В.И. Кулакова является ведущим учреждением страны, концентрирующим наиболее тяжелые случаи из регионов России, что также оказало влияние на такое распределение. Что касается продолжительности периода наблюдения, то I. Ulman и соавт. [25] рекомендуют консервативное ведение с тщательным мониторингом засостоянием пациента сего обследованием каждые 3 мес в течение первых 2 лет жизни. В нашем исследовании бóльшая часть операций (91%) выполнялась в раннем неонатальном периоде, что было обусловлено
значительным нарушением функции почек уже при рождении ребенка. К тому же, как показал
прослеженный нами катамнез длительностью более 5 лет, период реабилитации и восстановления функции почки значительно сокращается при ранней хирургической коррекции.
Ограничением нашего исследования является тот факт, что работа не была запланирована как проспективная. Кроме того, исследуемую группу составили новорожденные, у которых причиной увеличения ПЗРЛ были такие аномалии развития, как пузырно-мочеточниковый рефлюкс, клапан уретры и др. Такая неоднородность контингента больных детей могла привести как к снижению, так и к повышению частоты спонтанного разрешения уропатий и частоты оперативных вмешательств. Полученные данные свидетельствуют о том, что незначительное и умеренное увеличение ПЗРЛ почки, выявленное у плода, является относительно благоприятным и в большинстве случаев не требует хирургического вмешательства, что подтверждается и результатами других исследований [11, 14, 21].
Выраженное увеличение ПЗРЛ у плода часто приводит к неблагоприятному исходу и требует хирургической коррекции.
Врожденные уропатии, сопровождающиеся расширением собирательной системы почки, служат основанием для тщательного антенатального и постнатального наблюдения, а хирургическое вмешательство должно выполняться при значительном нарушении функционирования органа. Только совместные усилия акушеров, специалистов ультразвуковой диагностики, неонатологов, генетиков и детских урологов могут дать ответы на многие вопросы, касающиеся диагностики данной патологии и
тактики ведения пациентов. Полученные нами результаты позволяют влиять на тактику ведения беременности, определять сроки и методы родоразрешения, способствуют принятию решения о радикальном вмешательстве на дородовом этапе и в дальнейшем предотвращению развития тяжелых осложнений и инвалидизации ребенка.



