Профилактика, диагностика и лечение заболеваний молочных желез является актуальной современной медико-социальной проблемой. Это обусловлено неуклонным ростом частоты их онкологической патологии, которая занимает лидирующее место в структуре новообразований среди женского населения. Рак молочной железы занимает первое место в структуре онкологической заболеваемости (20,9%) и смертности женщин на территории Российской Федерации.
Наиболее частым заболеванием молочных желез в репродуктивном возрасте является мастопатия, или фиброзно-кистозная болезнь (ФКБ). В пременопаузальном возрасте фиброзно-кистозная болезнь составляет около 70% всех доброкачественных заболеваний молочных желез, среди женщин, страдающих различными гинекологическими заболеваниями, достигает 52%. По сути, термин «мастопатия» или «фиброзно-кистозная болезнь» используется для описания ряда морфологических изменений в молочной железе, которые могут сопровождаться клинической симптоматикой. В настоящее время выделяют непролиферативные и пролиферативные (в том числе атипическую гиперплазию) формы заболевания. Наиболее неблагоприятной в прогностическом плане является атипическая гиперплазия молочной железы, являющаяся фактором риска неопластической трансформации [1, 2].
Патогенез фиброзно-кистозной болезни в течение многих лет являлся предметом ряда исследований, результаты которых свидетельствуют о наличии его нескольких основных звеньев. Так, в развитии заболевания могут иметь значение такие факторы, как нарушение функции яичников, изменение рецепции к половым стероидным гормонам ее тканей, сочетающиеся с нарушением пролиферативной активности и апоптоза клеток млечного эпителия.
Взаимодействие прогестерона с «клеткой-мишенью» является многоэтапным процессом. Транспорт прогестерона в крови осуществляется транскортином. После освобождения прогестерона от транскортина прогестерон проникает в «клетку-мишень», где соединяется с прогестероновыми рецепторами. После изменения конформации рецептора его комплекс с прогестероном в ядре вступает в контакт с негистоновыми белками хроматина, воздействуя на ДНК и РНК-полимеразу. Это приводит к активации синтеза и-РНК и специфических белков, которые определяют ответ клетки с последующим каскадом различных метаболических процессов [3, 4].
Сведения, касающиеся влияния прогестерона на молочные железы, остаются неоднозначными [5–8]. Показано, что наибольшая пролиферативная активность эпителия млечных протоков у человека наблюдается во время лютеиновой фазы, в конце которой в дольках молочной железы наблюдается максимальная интенсивность синтеза ДНК и возрастает число митозов [8]. Имеется прямая взаимосвязь между концентрацией в крови прогестерона и пролиферативной активностью эпителия [9]. Однако в некоторых работах было показано, что прогестерон не влияет на митотическую активность эпителия или снижает ее [10]. Кроме этого, имеются сведения о том, что в условиях клеточной культуры прогестерон угнетает пролиферацию эпителия [10, 11]. Также предполагается, что эффект прогестерона на клеточный цикл может определяться длительностью воздействия гормона и его дозой [12].
В течение первых 12 ч воздействия на клетку он вызывает индукцию генов, ассоциированных с ускорением клеточного цикла. При этом увеличивается экспрессия циклинов Д1, Д3, Е, А, В, активируются комплекс циклинзависимых киназ (ЦЗК) 2 и 4, экспрессия протоонкогенов c-myc, c-fos, рRb, α-трансформирующего и эпидермального факторов роста. Через 24–48 ч после начала воздействия происходит остановка клеточного цикла в G1 фазе, что сопровождается снижением экспрессии циклинов Д1, Д3, Е, факторов рRb, p107, возрастанием экспрессии ингибиторов ЦЗК – р21 и р27, инактивацией ЦЗК. Последующее введение прогестерона, несмотря на достаточный уровень функционально активных прогестероновых рецепторов, не приводит к активизации клеточного цикла, пролонгируя состояние его покоя.
Модулирующее влияние на действие прогестерона могут оказывать факторы роста (инсулиноподобный, α и β-трансформирующие факторы роста, фактор роста фибробластов). В свою очередь, прогестерон способен увеличивать чувствительность к ним клетки молочной железы, менять уровень их экспрессии. Это достигается благодаря способности прогестерона на уровне клеточной мембраны, во-первых, изменять уровень рецепторов факторов роста, цитокинов, гормонов (например, инсулина), во-вторых, влиять в цитозоле на компартментализацию их внутриклеточных эффекторов (например, Stat 5), и в-третьих, в ядре клетки – воздействовать на ядерные транскрипционные факторы, зависимые от факторов роста и цитокинов. Кроме этого, предполагается, что прогестерон может снижать продукцию проапоптозного протеина р53 [12].
В настоящее время выделен классический ядерный прогестероновый рецептор, который экспрессируется в клетке в виде двух изоформ: А (ПРА) белок с молекулярной массой – 94 кДа, и В (ПРВ) – 114 кДа. ПРВ отличается наличием дополнительного 164-аминокислотного N-концевого участка в своей структуре [8, 13–15]. Экспрессия двух изоформ ПР кодируется в одном гене (11q22/PGR), в двух промотерных областях [8]. Дистальный промотор кодирует образование изоформы В, а проксимальный – изоформы А [8, 12, 15]. При эквимолярной экспрессии ПРА и ПРВ способны формировать гомодимеры (ПРА:ПРА) или гетеродимеры (ПРА:ПРВ), имеющих разную активность [12, 15]. ПРВ являются активаторами определенных, зависимых от них генов (генов мишеней) [12]. ПРА выполняют роль репрессоров активности рецепторов В. Чувствительность клетки к прогестерону моделируется величиной относительной экспрессии ПРА, и высокая их продукция может привести к снижению ответа клетки при воздействии прогестерона [8, 16].
Наряду с классическим ядерным прогестероновым рецептором выявлены белки, которые специфически связывают прогестерон на плазматической мембране. Так эти белки идентифицированы у животных: мембранные прогестиновые рецепторы (mPR), мембранные компоненты прогестеронового рецептора (PGRMC). Однако они практически не изучены у человека. Постнатально ПРB вызывают дифференцировку эпителия молочных желез в ответ на действие прогестерона в течение менструального цикла [8, 15].
Кроме этого, во время беременности они ответственны за боковое ветвление млечных протоков и развитие альвеол [17].
У человека ПР экспрессируются преимущественно эпителиальными клетками долек и протоков молочной железы [12]. При этом их экспрессия выше в мало дифференцированных дольках I типа по сравнению с более дифференцированными дольками II и III типа [8, 12, 15, 18]. Иммуногистохимический анализ образцов нормальной ткани молочной железы показал, что содержание рецепторов А-типа превосходит таковой рецепторов В-типа.
Данных об экспрессии рецепторов прогестерона в тканях молочной железы при гиперпластических процессах в молочной железе крайне мало. В ряде работ [12] выявлено увеличение ПРА при пролиферативных формах фиброзно-кистозных изменений. В исследованиях G. Branchini (2009) [18] показано, что содержание прогестероновых рецепторов выше в ткани фиброаденомы, чем в неизмененных участках органа. Считается, что содержание ПР в злокачественных опухолях молочной железы может определяться типом новообразования, его дифференцировкой, гистологическим строением, величиной опухоли, возрастом пациентки и рядом других факторов [19].
Неопластическая трансформация сопровождается усилением экспрессии прогестероновых рецепторов, преимущественно типа А, и, таким образом, изменением отношения ПРА/ПРВ.
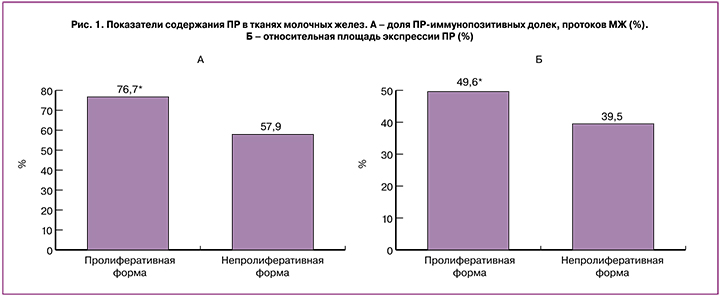
Согласно полученным нами данным, у больных как с непролиферативной, так и с пролиферативной формами фиброзно-кистозной болезни прогестероновые рецепторы содержат более 50% общего числа железистых структур (протоков и долек) молочной железы. При этом доля иммунопозитивных железистых структур у пациенток с пролиферативными формами составила 76,7±6,0%, что в 1,4 раза превышало аналогичный показатель у женщин, имеющих непролиферативную форму фиброзно-кистозной болезни (57,9±4,9%; р<0,05) (рис. 1). Относительная площадь ПР-иммунопозитивных ядер в млечном эпителии у больных с пролиферативной формой ФКБ была в 1,3 раза выше (49,6±2,6%) по сравнению с таковой при непролиферативной (39,5±3,1%; р<0,05) (рис. 1).
У человека и экспериментальных животных митотически активные эпителиальные клетки не содержат ПР. Предполагается, что влияние овариальных стероидов на их пролиферативную активность является опосредованным. Считается, что прогестерон взаимодействуют с ЭР- и ПР-позитивными митотически неактивными клетками. Последние, в свою очередь, продуцируют факторы, модулирующие митотическую активность рядом расположенных клеток, не содержащих ПР. Пролиферация эпителия возникает только при преобладании и достаточной силе паракринного митогенного воздействия, возникающего при длительном воздействии высокого уровня стероидов (например, при беременности). Данный физиологический механизм может обеспечивать протективную роль в отношении избыточной пролиферации клеток. В качестве возможных паракринных факторов действия эстрогенов рассматриваются эпидермальный, α-трансформирующий, инсулиноподобные факторы роста, фактор роста фибробластов и некоторые другие, прогестерона – гликопротеиды семейства Wnt [5, 6].
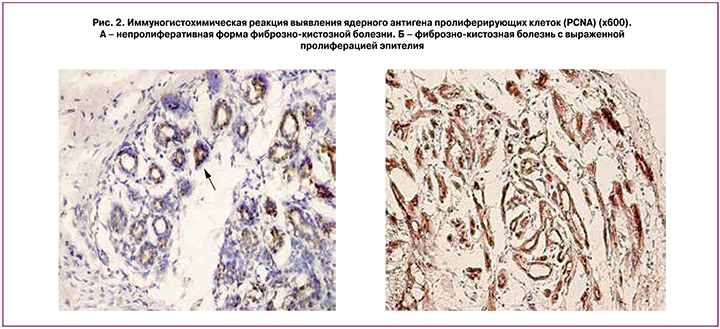
О пролиферативной активности эпителия судят на основании анализа содержания эндогенных маркеров пролиферации (ядерного антигена пролиферирующих клеток – PCNA и ядерного антигена Ki-67), для выявления факторов, участвующих в регуляторных механизмах апоптоза протеинов р53 и Mcl-1. По данным И.Ю. Когана (2007), при анализе содержания PCNA выявлено, что при пролиферативной форме ФКБ без атипии удельный вес PCNA-иммунопозитивных железистых структур был меньшим, а относительная площадь PCNA-иммунопозитивных ядер и оптическая плотность иммуногистохимического окрашивания – большей, чем при непролиферативной и пролиферативной (с атипией) формах заболевания. Достоверные отличия выявлены только в величине удельного веса PCNA-иммунопозитивных железистых структур между пролиферативной (без атипии) и непролиферативной формами (22,1±5,33% и 58,6±9,21% соответственно), а также между пролиферативной (без атипии) и атипической гиперплазией эпителия (22,1±5,33% и 60,72±7,23% соответственно); в величине относительной площади PCNA-иммунопозитивных ядер – между пролиферативной (без атипии) и непролиферативной формами ФКБ (44,94±6,17 и 23,26±5,4% соответственно); в величине оптической плотности иммуногистохимического окрашивания – между пролиферативной (без атипии) и непролиферативной формами (2,11±0,04 и 1,96±0,04 соответственно) (рис. 2) [1, 4].
При анализе содержания протеина Ki-67 было обнаружено, что при пролиферативной форме ФКБ без атипии удельный вес Ki-67-иммунопозитивных железистых структур был меньшим, а относительная площадь Ki-67-иммунопозитивных ядер и оптическая плотность иммуногистохимического окрашивания – большей, чем при непролиферативной и пролиферативной (с атипией) формах заболевания. Однако достоверные отличия выявлены только в величине относительной площади Ki-67-иммунопозитивных ядер – между пролиферативной (без атипии) и непролиферативной формами (31,35±3,57% и 20,27±2,81% соответственно).
Перспективным направлением патогенетического лечения мастопатии является разработка средств, влияющих на активность пролиферативных процессов в тканях молочных желез. Однако нужно отметить тот факт, что в течение длительного времени больным мастопатией рутинно назначали средства, не обладающие патогенетическим воздействием или с неустановленным механизмом воздействия при данном заболевании (физиотерапевтическое лечение, настойка валерианы, пустырника, пиона, пассифлоры, успокаивающие растительные сборы, анальгетики, противовоспалительные препараты из группы нестероидных противовоспалительных средств). С 60-х годов XX века в комплексе лечения ФКБ широко стали использовать витаминотерапию. В частности, применялись жиро- (Е, А) и водорастворимые (Р, С, В6, В1) витамины. Их применение основано на антиоксидантном (Е, С, Р), антиэстрогенным действии (А), а также улучшении микроциркуляции (С, Р).
В последнее годы в лечении мастопатии используют препарат из морской водоросли ламинарии (мамоклам), содержащий в своем составе йод (100 мг), полиненасыщенные жирные кислоты омега-3 типа (40 мг), хлорофилл (10 мг). В настоящее время имеются сведения о способности компонентов, входящих в состав мамоклама, снижать риск развития рака молочных желез. Так, хорошо известно, что при высоком потреблении морских водорослей в пищу отмечается низкая заболеваемость раком, а увеличение потребления рыбы и других морепродуктов, богатых полиненасыщенными жирными кислотами омега-3, также снижает риск развития этого заболевания. Кроме этого, пищевой дефицит йода, заболевания щитовидной железы ассоциируются с увеличением риска рака молочной железы. Известно, что полиненасыщенные омега-3 жирные кислоты обладают ингибирующим эффектом в отношении канцерогенеза, в частности стадии промоции и прогрессии. Это обеспечивается снижением синтеза эстрогенов, продукции свободных радикалов, влиянием на активность пролиферации, апоптоза и дифференцировку клеток. В экспериментах на лабораторных животных показано, что активные субстанции мамоклама тормозят развитие индуцированных канцерогенами и спонтанных опухолей молочных желез. В ряде исследований доказана клиническая эффективность мамоклама при лечении диффузной мастопатии. В частности, было доказано, что лечебный эффект препарата наиболее ярко проявляется в отношении масталгии при всех вариантах мастопатии (с преобладанием железистого, фиброзного, кистозного компонента) – у 90% пациенток отмечено исчезновение боли в молочных железах. Кроме этого, после проведенного лечения более чем у половины больных наблюдалось уменьшение плотности и болезненности тканей молочных желез, а у части больных – регрессирование кист. Авторы также отмечают другие клинические эффекты мамоклама – снижение интенсивности дисменореи, уменьшение продолжительности и объема менструальных выделений, а также положительное влияние на психоэмоциональное состояние женщин (повышение активности, улучшение настроения, снижение чувства тревоги, улучшение сна). В ряде исследований выявлено, что через 6 месяцев лечения мамокламом у 65,3% пациенток отмечалось уменьшение толщины паренхимы молочной железы, у 62,2% – исчезновение дуктэктазии, у 75% – регрессия кист (по данным ультразвукового исследования). Таким образом, выявленные антипролиферативные эффекты препарата мамоклам могут быть использованы с целью комплексного патогенетического подхода в лечении мастопатии.



