Полипы эндометрия (ПЭ) занимают первое место среди внутриматочной патологии у пациенток пожилого возраста и встречаются с частотой 39,2–69,3% [1, 2], а у женщин с кровотечением в постменопаузе – с частотой от 16 до 54% [2–6].
ПЭ рассматривают как локальную доброкачественную опухоль, исходящую из базального слоя эндометрия. Вопрос о клеточном источнике развития ПЭ до настоящего времени не изучен. J. Fletcher утверждает, что полипы эндометрия представляют собой моноклональные образования из генетически поврежденных стромальных клеток эндометрия, с вторичным вовлечением железистого эпителия [7]. Хромосомный анализ стромы полипов выявил в большинстве случаев клональные транслокации, включающие в себя регионы 6р21-22, 12q13-15 или 7q22 [8].
У женщин в постменопаузе механизмы патогенеза ПЭ недостаточно изучены, а гипотеза эстрогенной стимуляции в развитии ПЭ в постменопаузе может рассматриваться как парадоксальная [9]. В литературе обсуждаются механизмы автономности роста ПЭ за счет гиперпродукции факторов роста с одновременной экспрессией и относительного снижения уровня апоптоза. Высказано предположение, что дисбаланс между факторами пролиферативного ответа и апоптоза в сторону первого на ограниченном участке является одним из патогенетических факторов, лежащих в основе развития ПЭ в репродуктивном возрасте [10]. Однако данный факт в ПЭ у женщин в постменопаузе практически не изучался [9]. В проведенных ранее исследованиях по изучению рецепторов к стероидным гормонам, экспрессии маркеров пролиферации и апоптоза в ПЭ получены весьма противоречивые данные [10–14]. Это можно объяснить тем, что в группы объединялись больные с давностью постменопаузы от 1 года до 47 лет, больные с приемом ЗГТ или тамоксифена в анамнезе, а самое главное, как мы считаем, это отсутствие учета гистологического типа ПЭ.
Целью нашего исследования стало морфологическое изучение процессов роста, неоангиогенеза, старения и апоптоза в полипах и окружающем их эндометрии у женщин в постменопаузе.
Материал и методы
 В исследовании были включены 46 женщин, из них в основную группу – 28 морфологически подтвержденных случаев ПЭ. При разделении ПЭ на подгруппы нами была принята рабочая классификация, по которой были определены 2 группы: аденоматозные (АП) – 11 случаев и фиброзно-железистые (ФЖП) – 17 случаев. В группу сравнения были отобраны 18 пациенток в постменопаузе (более 10 лет) без патологии эндометрия (контрольный эндометрий – КЭ), которым было проведено оперативное лечение по поводу пролапса гениталий. Критериями включения в группу с ПЭ были: постменопауза более 10 лет, наличие ПЭ на фоне атрофичного эндометрия. Критерии включения в группу без ПЭ: постменопауза более 10 лет, атрофичный эндометрий. Критериями исключения для всех групп были: прием гормонально активных препаратов (ЗГТ, тамоксифен) в анамнезе, прием НПВС в течение последних 6 месяцев, гиперплазия эндометрия, аденокарцинома эндометрия, сопутствующие миома матки и аденомиоз, хронический эндометрит, опухоли яичников.
В исследовании были включены 46 женщин, из них в основную группу – 28 морфологически подтвержденных случаев ПЭ. При разделении ПЭ на подгруппы нами была принята рабочая классификация, по которой были определены 2 группы: аденоматозные (АП) – 11 случаев и фиброзно-железистые (ФЖП) – 17 случаев. В группу сравнения были отобраны 18 пациенток в постменопаузе (более 10 лет) без патологии эндометрия (контрольный эндометрий – КЭ), которым было проведено оперативное лечение по поводу пролапса гениталий. Критериями включения в группу с ПЭ были: постменопауза более 10 лет, наличие ПЭ на фоне атрофичного эндометрия. Критерии включения в группу без ПЭ: постменопауза более 10 лет, атрофичный эндометрий. Критериями исключения для всех групп были: прием гормонально активных препаратов (ЗГТ, тамоксифен) в анамнезе, прием НПВС в течение последних 6 месяцев, гиперплазия эндометрия, аденокарцинома эндометрия, сопутствующие миома матки и аденомиоз, хронический эндометрит, опухоли яичников.
На I этапе исследования был проведен анализ акушерского, гинекологического и соматического здоровья пациенток с ПЭ. Всем пациенткам с подозрением на ПЭ проводилась диагностическая гистероскопия по общепринятой методике [15], далее, при подтверждении диагноза, проводилось гистеророрезектоскопическое локальное удаление ПЭ, биопсия окружающего эндометрия и раздельное диагностическое выскабливание полости матки и цервикального канала.
Далее было проведено иммуногистохимическое (ИГХ) исследование полипов и образцов эндометрия. Иммуногистохимические реакции проводились на серийных парафиновых срезах толщиной 4 мкм, расположенных на стеклах, покрытых L-полизином. Демаскировка антигенов для ИГХ проводилась в ретривере с использованием цитратного буфера (рН 6,0) и при мощности 600 Вт. В качестве первичных антител применялись моноклональные и поликлональные антитела к ApoCas (Novocastra, Великобритания), Ki-67 (клон MIB-1, DAKO, Дания), VEGF-А (Abbiotec, США), PTEN (клон pS380, Epitomics, США), p16INK4a (клон R1473, AbCam, Великобритания). В качестве вторичных антител использовали наборы Dako REALTM EnVisionTM Detection System, Peroxidase/DAB+, Rabbit/Mouse (Code K5007). Ставились положительные и отрицательные контрольные реакции. Отрицательный контроль был представлен срезами, которые подвергались стандартной процедуре иммуногистохимии, но без добавления первичных антител. Положительный контроль для каждого антитела выбирали в соответствии со спецификациями от фирмы производителя. Оценку экспрессии маркеров осуществляли путем подсчета процента окрашенных клеток на 3000 клеток одного типа.
Статистическая обработка проводилась с помощью SPSS17 Statistics 17.0. Статистический анализ проводился непараметрическим методом с помощью U-критерия Манна–Уитни. Для установления корреляции между структурными изменениями и уровнем экспрессии маркеров в паренхиме и строме использовался коэффициент линейной корреляции Пирсона. Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05.
Результаты исследования
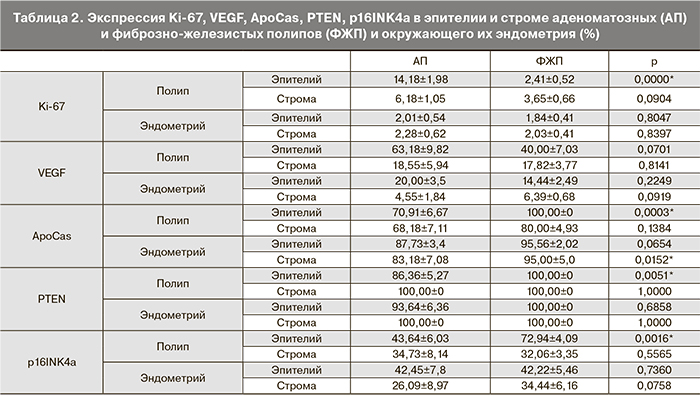
Результаты клинического обследования пациенток, включенных в исследование, представлены в табл. 1. Возраст пациенток составил в среднем 69,04±6,7 годаа и варьировал от 58 до 86 лет. Пациентки всех 3 групп были сопоставимы и не различались по основным клиническим параметрам (возраст, возраст менопаузы, длительность менопаузы, соматические заболевания). Обращает на себя внимание более высокая частота АП с диаметром более 3 см. Также в группе АП было больше пациенток с ожирением (ИМТ>30кг/м2). Из 28 пациенток с ПЭ 11 (39,2%) предъявляли жалобы на кровяные выделения из половых путей. Была выявлена умеренная положительная корреляция между ИМТ и наличием симптома кровотечения (r=0,51; p<0,0001), количеством РДВ в анамнезе и рецидивом ПЭ (r=0,62; p<0,0001).
При морфологическом исследовании АП были построены из гиперплазированных тубулярных железистых структур, расположенных среди фиброзной стромы (рис. 1а см. на вклейке). У 2 пациенток с АП отмечены признаки клеточной атипии в железистых структурах. ФЖП при микроскопическом исследовании были представлены разрастаниями фиброзной ткани с включением в него желез, нередко кистозно-трансформированных (рис. 1б см. на вклейке). При наличии симптома кровотечения отмечались дисциркуляторные расстройства в ткани полипа. Эндометрий, окружающий оба типа полипов, был атрофичным во всех случаях. Различалась простая (36% случаев при АП, 47% случаев при ФЖП и 56% случаев КЭ) и кистозная атрофия эндометрия. В атрофичном эндометрии функциональный слой был неотличим от базального, с содержанием небольшого количества мелких желез, выстланных однорядным низким цилиндрическим эпителием. При кистозной атрофии кистозно расширенные железы были выстланы однорядным уплощенным эпителием.
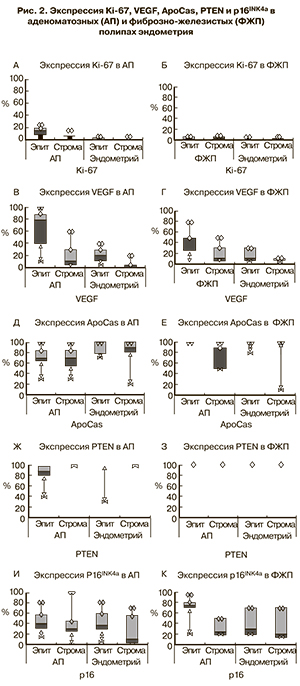
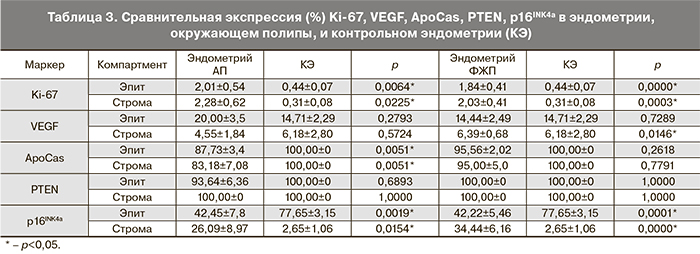
Оценка пролиферативной активности проводилась путем изучения экспрессии Ki-67 при ИГХ-исследовании (рис. 1в, г см. на вклейке; рис. 2а, б). Выявлена значительно высокая его экспрессия в эпителии АП в сравнении со стромой АП (р=0,003) и эпителием окружающего эндометрия (р=0,003). В строме АП выявлена более высокая его экспрессия, чем в строме окружающего эндометрия (р=0,012). Экспрессия Ki-67 в строме ФЖП была значимо выше, чем и в эпителии полипов, и в строме окружающего эндометрия (p=0,017 и p=0,012 соответственно). А эпителий ФЖП и окружающего их эндометрия не отличались по экспрессии Ki-67. При сравнении пролиферативной активности АП и ФЖП (табл. 2 и 3) установлено, что экспрессия Ki-67 в эпителии АП была значительно выше, чем в эпителии ФЖП (р<0,0001). И эпителиальная, и стромальная экспрессия Ki-67 в эндометрии, окружающем оба типа полипов, оказались достоверно выше, чем соответствующие показатели КЭ (р=0,0064 и р=0,0225 соответственно при АП и р<0,00001 и р=0,0003 соответственно при ФЖП). При наличии симптома кровотечения пролиферативная активность значимо выше в эпителии ФЖП (p=0,0006) и в строме полипов, вне зависимости от гистотипа (p<0,05), чем при отсутствии такового.
Наряду с пролиферативной активностью, интерес представляла экспрессия фактора роста VEGF как прямого показателя неоангиогенеза (рис. 1д, е см. на вклейке; рис. 2в, г). Тенденции в экспрессии VEGF в АП были схожи с таковыми при ФЖП. Так, в эпителии и строме полипов экспрессия VEGF была значимо выше, чем в соответствующих отделах окружающего их эндометрия (p=0,011 и p=0,008 соответственно при АП и p=0,003 и p=0,008 соответственно при ФЖП). А эпителиальная экспрессия маркера была значимо выше, чем стромальная и в полипе, и в окружающем его эндометрии (p=0,005 и p=0,011 соответственно при АП и p=0,01 и p=0,03 соответственно при ФЖП). Значимой разницы между соответствующими компартментами АП и ФЖП в экспрессии VEGF выявлено не было. Стромальная экспрессия маркера в окружающем ФЖП эндометрии оказалась значимо выше, чем в КЭ (p=0,015) (см. табл. 2 и 3). Однако при обоих типах полипов, при наличии симптома кровотечения, стромальная экспрессия VEGF была значительно (в 4 раза) выше, чем при отсутствии симптомов (p=0,0001).
Для изучения готовности к апоптозу в клетках эпителия и стромы полипов и эндометрия мы изучили экспрессию ApoCas (рис. 3а, б см. на вклейке; рис. 2д, е; см. табл. 2 и 3). Эпителий и строма АП не отличались между собой по экспрессии данного маркера – в обоих компартментах он был одинаково снижен. Значимое снижение ApoCas отмечено в эпителии АП относительно эпителия окружающего их эндометрия (р=0,038). Экспрессия ApoCas оказалась снижена в строме ФЖП относительно их эпителия (p=0,001). А стромальная экспрессия ApoCаs в окружающем ФЖП эндометрии была ниже, чем в строме полипа (р=0,007). Эпителий АП и строма эндометрия, окружающего АП, отличались от соответствующих компартментов ФЖП более низкой экспрессией данного маркера (р=0,0003 и р=0,0152 соответственно). Значимое снижение экспрессии маркера относительно КЭ было выявлено в эндометрии, окружающем АП (в эпителии р=0,0051, в строме р=0,0051).
Исследование экспрессии белковых продуктов гена супрессора рака PTEN (рис. 3в, г см. на вклейке; рис. 2ж, з) выявило снижение его экспрессии в эпителии АП относительно стромы (р=0,018). Обращает на себя внимание, что в 2 случаях аденоматозных полипов с клеточной атипией нами было выявлена значительная потеря PTEN (до 40% в эпителии АП и до 30% в эпителии эндометрия, окружающего АП). В 54,5% случаев АП экспрессия PTEN была снижена до 80%. Статистически значимых различий в экспрессии PTEN между компартментами ФЖП и окружающего их эндометрия не было выявлено. АП отличались от ФЖП (см. табл. 2 и 3) значимым снижением экспрессии PTEN в эпителии АП (p=0,0051). Также экспрессия PTEN в эпителии окружающего АП эндометрия была ниже, чем в эпителии эндометрия, окружающего ФЖП, но данные значения были статистически незначимыми (р=0,68). Стромальная экспрессия маркера и в полипах, и в эндометрии не отличалась, так же как и эпителиальная и стромальная экспрессия PTEN между полипоидным и контрольным эндометрием.
Экспрессия p16INK4a оценивалась нами с учетом индекса пролиферативной активности клеток (рис. 3д, е см. на вклейке; рис. 2 и, к; см. табл. 2 и 3), поскольку известно, что экспрессия p16INK4a повышается в «стареющих» клетках [16–18]. При это, маркер пролиферации Ki-67 в них не выявляется. С другой стороны, коэкспрессия Ki-67 и p16INK4a может свидетельствовать о злокачественной трансформации клеток [19]. В АП отмечена высокая и умеренная экспрессия p16INK4a в клетках эпителия и стромы. При этом обнаруживались отдельные группы эпителиальных клеток, в которых имелась коэкспрессия Ki-67 и p16INK4a. Относительное содержание «стареющих» клеток в эпителии и строме АП и окружающего их эндометрия статистически не различались. В эпителии ФЖП экспрессия p16INK4a была значимо выше, чем в эпителии окружающего эндометрия (p=0,0005). А его эпителиальная экспрессия значимо преобладала над стромальной и в полипе, и в окружающем его эндометрии (p=0,0004 и p=0,028 соответственно). Но при этом не выявлено коэкспрессии двух маркеров, что позволяет отнести эти клетки к разряду «стареющих». АП отличались от ФЖП несколько низкой эпителиальной экспрессией p16INK4a (p=0,016). КЭ, в отличие от эндометрия, окружающего ПЭ, представлен «стареющими» клетками с высокой экспрессией p16INK4a и практически нулевой экспрессией Ki-67. В эндометрии окружающем АП и ФЖП эпителиальная экспрессия p16INK4a была ниже, чем в КЭ (ЭАП-КЭ: р=0,002; ЭФЖП-КЭ: р=0,0001 соответственно), что говорит о более низком содержании «стареющих» клеток, но в сочетании с относительно высокими показателями Ki-67.
Обсуждение
Полученные нами результаты позволяют обсудить проблему роста и рецидива ПЭ в постменопаузе, возможность их злокачественной трансформации, изменения окружающего эндометрия и механизмы маточных кровотечений при данной патологии.
Ki-67 экспрессируется только в пролиферирующих клетках, соответственно, является маркером измерения потенциала роста в данной популяции клеток. В нормальном пременопаузальном эндометрии пик Ki-67 наблюдается в фазу пролиферации. Он также высоко экспрессируется в эндометриальной карциноме высокой степени, но в ПЭ отмечается очень низкая экспрессия [13]. В нашем исследовании обращает на себя внимание пролиферативная активность эпителия АП, которая в несколько раз превышает показатели всех других компартментов. При этом фокусы коэкспресии p16INK4a и Ki-67 могут свидетельствовать о начавшейся злокачественной трансформации. А выявленная нами в 2 случаях АП потеря PTEN указывает на возможность развития аденокарциномы в АП, что подтверждается клиническими наблюдениями [20]. При наличии симптома кровотечения и в эпителии, и в строме всех ПЭ выявлена более высокая пролиферативная активность. Более высокая пролиферативная активность в эндометрии, окружающем ПЭ, вне зависимости от гистотипа, относительно КЭ, указывает на пересмотр лечебной тактики и объема деструкции эндометрия, особенно при ФЖП в постменопаузе. В исследованиях, посвященных изучению факторов пролиферации и апоптоза в ПЭ, авторами высказываются довольно разнообразные заключения. Так, Maia и соавт. [11] утверждают, что продукция клетками самого полипа факторов роста свидетельствует о возможности его автономного роста и может объяснить сосуществование пролиферирующих полипов с окружающим атрофичным эндометрием и более высокую чувствительность полипов к воздействию на их клетки высокого уровня гонадотропинов и низкого уровня эстрогенов, что характерно для женщин в постменопаузе. L.J. Taylor и соавт. (2003) показали, что ПЭ в пременопаузе имеют повышенную экспрессию Bcl-2 (протоонкогена, который пролонгирует жизнь клеток, ингибируя апоптоз) и в стромальных, и в эпителиальных клетках в сравнении с нормальным эндометрием в пролиферативную фазу, что приводит к снижению апоптоза и усилению пролиферации в ткани полипов [10]. С другой стороны, Maia и соавт. не выявили разницы в степени интенсивности экспрессии Bcl-2 между ПЭ в пременопаузе и нормальным эндометрием [12]. Единственным маркером пролиферации, который показал значительную разницу, был Ki-67, который был значительно выше в строме, что указывает на повышенное деление клеток в строме полипа. В нашем исследовании также была выявлена значимая более высокая стромальная экспрессия Ki-67 относительно стромы окружающего эндометрия при обоих типах ПЭ.
Другая точка зрения о механизмах роста ПЭ базируется на данных об угнетении в них апоптоза, что пролонгирует жизнь клеток и приводит к увеличению ПЭ в размерах. Предыдущие исследования показали, что относительно окружающего эндометрия в железах и строме ПЭ экспрессия Ki-67 ниже, а Bcl-2 выше [10, 13]. Это и привело к появлению гипотезы, что полипы, в сущности, не являются митотически гиперактивными, а развиваются из-за дефекта в механизмах природного контроля апоптоза, приводящего к увеличению продолжительности жизни клеток [10].
Особый интерес представляло соотношение процессов пролиферации и апоптоза в разных компартментах полипов и эндометрия. В атрофичном эндометрии без полипов (КЭ) наблюдалось абсолютное преобладание готовности к апоптозу с минимальной пролиферативной активностью. При исследовании АП и ФЖП отмечалось прогрессивное снижение апоптотической активности и увеличение процессов пролиферации, что выражалось повышением экспрессии Ki-67 и снижением ApoCas. При этом данная тенденция наблюдалась во всех компартментах полипов и окружающего их эндометрия, но наиболее четко была выражена в эпителии АП и строме ФЖП. Как показало наше исследование рецепторного статуса ПЭ (данные в печати), АП являются прогестерон-зависимыми, в отличие от ФЖП. Данные различия в рецепторном статусе, соотношении процессов апоптоза и пролиферации в разных компартментах полипов позволяют рассуждать, что АП и ФЖП имеют различные механизмы развития. Рост АП, по-видимому, зависит не только от моноклональной стромы, но в большей степени от поликлонального железистого эпителия. Более низкий уровень Ki-67 в эпителии ФЖП говорит о низком уровне пролиферации эпителия ФЖП. Преобладание стромального компонента над железистым в данных типах полипов проявляется тем, что пролиферативная активность стромы выше, чем активность эпителия. Поэтому, фиброзно-железистые полипы могут бессимптомно дорасти до 6–8 см в диаметре, заполняя всю полость матки. Как только активируется эпителиальный компонент и в нем усиливается пролиферация, развиваются аденоматозные полипы. Обращает на себя внимание, что при наличии симптома кровотечения, апоптоз в эпителии эндометрия, окружающем все типы полипов, несколько ниже, чем в эпителии эндометрия, окружающем бессимптомные полипы, и эта разница близка к статистически значимой (p=0,057).
Интересные данные получены нами в отношении маркера неопластической трансформации в эндометрии PTEN. Белок, кодируемый геном PTEN (Phosphatase and tensin homolog), сигнализирует клетке о необходимости прекращения деления и способствует ее вступлению в апоптоз, осуществляя, таким образом, супрессорную функцию, препятствуя возникновению рака. В клетках с инактивированным геном PTEN наблюдается стимуляция клеточной пролиферации [21, 22]. Потеря функции PTEN делает клетки менее чувствительными ко многим апоптогенным стимулам [23]. Отсутствие экспрессии PTEN следует расценивать как предиктор неопластических изменений в эндометрии [24]. Изменения показателей эпителиальной и стромальной пролиферации свидетельствует о нарушении баланса в уровне пролиферативной активности между эпителием желёз и клетками стромы при АП. В случаях рецидивов полипов всех гистотипов отмечается снижение PTEN в эпителии окружающего эндометрия в сравнении с полипами без рецидива, что говорит о повышенной пролиферативной активности эпителия эндометрия всех полипов с рецидивом. Наше исследование позволяет связать пролиферацию клеток ПЭ и окружающего их эндометрия, характер и степень этой пролиферации с состоянием активности гена PTEN при различных типах ПЭ. Вероятно, при аденоматозных ПЭ происходит снижение активности гена-супрессора PTEN, угнетение апоптоза клеток эндометрия и соответственно несбалансированная активация пролиферативных процессов в нем. 2 случая АП с клеточной атипией и значительной потерей PTEN позволяют провести параллели исследованиям эндометриальной интраэпителиальной гиперплазии и рака эндометрия [25] и выделить 2 подтипа АП: с частичной потерей PTEN и без.
Другим маркером неопластической трансформации может считаться p16INK4a, ингибитор циклин-зависимых киназ и регулятор клеточного цикла, который в то же время является одним из ключевых регуляторов клеточного старения. Экспрессия p16INK4a заметно увеличивается с возрастом практически во всех тканях [16–18]. Обращает на себя внимание значительно высокая экспрессия данного белка в эпителии КЭ, к которой приближались показатели эпителиальной экспрессии в эндометрии, окружающем ЖФП. Однако если КЭ характеризовался исключительно «стареющими» клетками, эндометрий, окружающий полипы, имел более низкий процент таких клеток с относительно высокой экспрессией Ki-67. Так как p16INK4a является регулятором клеточного цикла и соответственно должен уменьшать пролиферацию при отсутствии опухолевого роста, нам было интересно изучить корреляцию p16INK4a и Ki-67 в разных компартментах полипов и эндометрия. Как и следовало ожидать, выявлена отрицательная корреляция между данными маркерами в эпителии полипов (r=–0,453; p=0,016) и в эпителии эндометрия (r=–0,441; p=0,002).
Результаты экспрессии VEGF в разных компартментах полипов и окружающего их эндометрия полностью соответствовали данным других исследований [26]. Обращает на себя внимание значительно высокая экспрессия VEGF в строме полипов обоих типов при наличии симптома кровотечения относительно стромы полипов при бессимптомных полипах.
Заключение
Проведенное исследование доказывает, что АП и ФЖП отличаются не только по морфологическому строению, но и по молекулярным параметрам, следовательно, могут иметь различные механизмы патогенеза, четкое понимание которых может привести к усовершенствованию дифференцированного подхода к их лечению. Эпителий АП отличается высоким уровнем пролиферации, низкой выраженностью апоптоза, а в некоторых случаях изменениями, характерными для злокачественной трансформации клеток (потеря PTEN, коэкспрессия p16INK4a и Ki-67). Выявлены также синхронные изменения в окружающем полипы эндометрии, что указывает на то, что в эндометрии пациенток с ПЭ формируется «опухолевое поле», являющееся плацдармом для развития неоплазий. При этом эндометрий, окружающий разные типы полипов, отличается как между собой, так и более высокой пролиферативной активностью в сравнении с контрольным эндометрием, что следует учитывать при выборе лечебной тактики и объема деструкции эндометрия при данной патологии. Наличие симптома кровотечения и рецидив полипов свидетельствуют о более высокой пролиферативной активности в полипах и окружающем их эндометрии, что дает основания учитывать эти клинические данные при выборе тактики лечения.



