В настоящее время пролиферативные заболевания эндометрия остаются одной из причин, приводящих к развитию рака эндометрия, однако по-прежнему отсутствуют радикальные меры в отношении их лечения. Ичзвестными причинами их возникновения являются изменение гормонального, иммунного статуса женщин, влияние сопутствующих соматических заболеваний. В последние годы все больше внимания уделяется изучению роли мезенхимных клеток (МСК) в функциональной активности эндометрия и развитии различных патологий [1–8]. По существующей гипотезе, МСК являются одним из основных источников регенерации эндометрия [7, 8], а изменение их функций и/или фенотипа – непосредственными факторами, определяющими развитие пролиферативных заболеваний матки. Среди различных механизмов, лежащих в основе изменений стромальных клеток эндометрия при патологии, обнаружено, что при различных заболеваниях наблюдается изменение адгезивных свойств, увеличение миграторного потенциала, способности клеток к инвазии и продукции ангиогенных факторов роста [4]. Кроме того, изменение пролиферативных характеристик эндометриальных мезенхимных клеток может быть ключевым механизмом увеличения объема эндометриальной ткани и изменения ее морфофункциональных свойств. Известно, что изменение экспрессии опухолевых супрессоров, таких как PTEN, p16 и p53, а также теломеразной активности в клетках является фактором, сопутствующим патологическим процессам в разных тканях, главным образом развитию онкологических заболеваний [9, 10]. Кроме того, показано, что нарушение функций стромальных клеток, независимо от типа ткани, сопровождает опухолевый рост или является причиной его, а также инвазии опухолевых клеток в прилежащие ткани [11].
Ранее мы показали, что популяция клеток, выделяемых из эндометрия здоровых доноров и эндометрия при пролиферативных заболеваниях, содержит клетки мезенхимного ряда [12], соответствующие минимальным критериям определения мезенхимных стромальных клеток и принятых Международным обществом по клеточной терапии [13]. В настоящей работе с целью выявления механизмов развития заболеваний эндометрия мы оценивали инвазивный потенциал, пролиферативные свойства, а также экспрессию генов-регуляторов клеточного цикла и онкосупрессоров мезенхимными клетками, выделенными из нормального неизмененного эндометрия и эндометрия при пролиферативных заболеваниях – гиперпластических процессах эндометрия (ГПЭ), аденомиозе (АМ) и миоме матки (ММ).
Материал и методы исследования
Исследование проводилось на базе кафедры биохимии и молекулярной медицины факультета фундаментальной медицины МГУ им. М.В. Ломоносова, кафедры акушерства и гинекологии с курсом перинатологии РУДН, гинекологических отделений ГКБ № 12 и ГКБ № 64. В обследование были включены 110 пациенток репродуктивного возраста, у которых при раздельном диагностическом выскабливании слизистой матки и аспирационной биопсии эндометрия были получены образцы эндометриальной ткани. Критериями включения в исследование считали наличие у пациенток ГПЭ без атипических проявлений; ММ или АМ, эндометрий при которых находился в пролиферативной или секреторной фазе; репродуктивный возраст женщин; отсутствие в анамнезе заболеваний щитовидной железы, сердечно-сосудистой системы, сахарного диабета, заболеваний почек, онкозаболеваний. В работе были проанализированы анамнестические данные пациенток, включавшие особенности преморбидного фона, перенесенные сопутствующие гинекологические заболевания, оперативные вмешательства, особенности менструальной, половой и репродуктивной функции. Гинекологический статус определялся на основании осмотра наружных половых органов, исследования влагалища и шейки матки с помощью зеркал, результатов бимануального влагалищного исследования.
В работе были использованы образцы эндометрия 34 женщин 26–47 лет. Средний возраст пациенток составил 38,6±6,7 года. Все женщины были разделены на четыре группы. Первая группа включала 10 пациенток с диагностированным по результатам гистологического исследования ГПЭ, у 6 из них была выявлена гиперплазия эндометрия без атипии, у 4 – обнаружены полипы эндометрия. Во вторую группу были включены 6 пациенток, у которых по данным ультразвукового исследования (УЗИ) органов малого таза, а также при гистероскопии были обнаружены признаки АМ. В третью группу были включены 9 женщин с ММ (по данным УЗИ органов малого таза), у которых не наблюдалось изменений эндометрия пролиферативной или секреторной фазы, согласно результатам гистологического исследования. Контрольная группа включала 9 женщин, у которых по данным гистологического исследования не наблюдалось патологических изменений эндометрия пролиферативной или секреторной фазы менструального цикла.
Биоптаты эндометриальной ткани получали при раздельном диагностическом выскабливании слизистой матки. Фрагменты эндометриальной ткани помещали в пробирки, содержащие стерильный раствор Хэнкса (HyClone) c антибиотиком, и транспортировали в лабораторию. Все манипуляции с первичным материалом проводили в стерильных условиях ламинарного бокса.

Эндометриальную ткань подвергали механической дезагрегации и помещали в среду для культивирования недифференцированных мезенхимных стволовых клеток AdvanceSTEM (Basal Medium for Undifferentiated Mesenchimal Human Stem Cells, HyClone), с 10% добавлением ростовых добавок (Stem Cell Growth Supplement, HyClone) и раствором антибиотика/антимикотика (Antibiotic/Antimycotic Solution, HyClone). Прикрепившиеся клетки культивировали в условиях CO2-инкубатора при температуре 37° С и 5% CO2 до достижения субконфлуэнтного монослоя. Клетки культивировали до 2-го пассажа и использовали для выявления экспрессии белков.
Для выявления фенотипических особенностей мезенхимных стромальных клеток нормального эндометрия и эндометрия при заболеваниях был использован метод двойного иммунофлуоресцентного окрашивания. Использовали антитела для выявления белков, регулирующих процессы ремоделирования внеклеточного матрикса и направленной миграции (урокиназа (uPA), урокиназный рецептор (uPAR), матриксная металлопротеиназа 3 (MMP3), T-кадгерин), а также антитела к теломеразе, Ki-67 и белкам-регуляторам клеточного цикла и онкосупрессорам (р16, р53, с-Met, PTEN).
Клетки эндометрия 2-го пассажа фиксировали в соответствии с протоколами производителей антител и инкубировали с моноклональными мышиными или кроличьими антителами против антигенов человека T-кадгерин (ProSci); c-Met (Invitrogen); р16 (Abcam); uPA (R&D); uPAR (AmD); MMP3 (Abcam), р53 (Sigma), PTEN (Abcam), теломераза (LifeSpan BioSciences), Ki-67 (BD Pharmingen), которые разводили в 1% растворе бычьего сывороточного альбумина (HyClone) на PBS. В качестве контроля использовали изотипические иммуноглобулины мыши Purified Mouse IgG1, k isotype control (BD Phfarmingen) и кролика Purified Rabbit IgG isotype control (Santa Cruz Biotechnology). В качестве вторых антител использовали флуоресцентно-меченные антитела козы против иммуноглобулинов мыши или кролика Goat – anti – mouse, Alexa 594 (Invitrogen) или Goat – anti – rabbit, Alexa 594 (Invitrogen) в разведении 1:1000. Получение и анализ изображений проводили с использованием флуоресцентного микроскопа Leica DM 6000 B (Leica Microsystems CMS GmbH, Germany), оснащенного цифровой камерой высокого разрешения и программы LAS AF.
Для статистической обработки результатов применяли ППП Statistica StatSoft 8.0. Анализ результатов осуществляли с помощью определения χ2 Пирсона, метода ранговых корреляций Спирмена, достоверными считали различия при p<0,05.
Результаты исследования и обсуждение
Окраска эндометриальных клеток 2-го пассажа, выделенных из неизмененного эндометрия и эндометрия пациенток с пролиферативными заболеваниями матки, антителами, выявляющими компоненты урокиназной системы, показали, что клетки всех исследованных образцов не экспрессировали uPAR. Исследование было выполнено с использованием моноклональных антител против uPAR двух разных производителей.
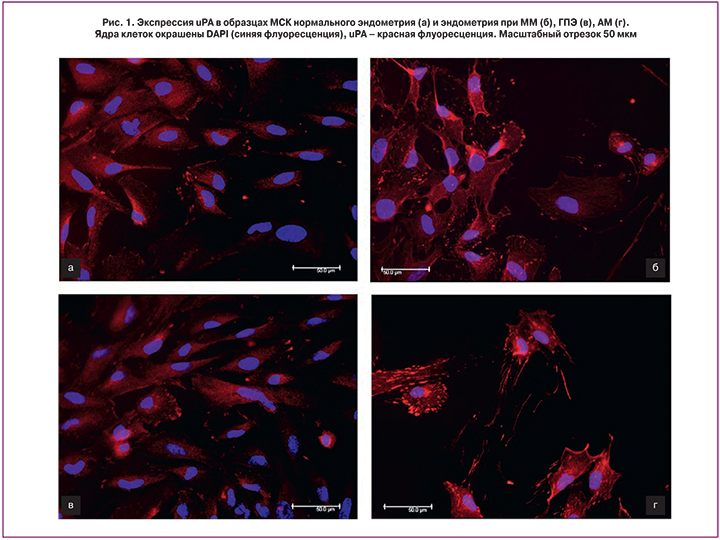
Вместе с тем обнаружено, что исследуемые популяции клеток, выделенные из нормального эндометрия и эндометрия пациенток с ГПЭ, ММ, АМ, экспрессировали uPA (рис. 1).
Иммуноцитохимическое исследование также выявило, что клетки всех образцов одинаково экспрессировали ММР3, что позволяет предполагать отсутствие разницы в способности этих клеток ремоделировать внеклеточный матрикс. Кроме того, обнаружено, что клетки всех исследованных образцов содержали Т-кадгерин (рис. 2), утрата экспрессии которого, как было показано ранее, характерна для ряда опухолевых тканей [14, 15].
Таким образом, в этой части работы получены новые данные, касающиеся экспрессии Т-кадгерина, компонентов урокиназной системы и MMP3, ответственных за ремоделирование и инвазию стромы в прилежащие ткани, в эндометрии в норме и при пролиферативных заболеваниях. Однако различий в экспрессии этих белков МСК нормального эндометрия и эндометрия пациенток с пролиферативными заболеваниями выявлено не было.

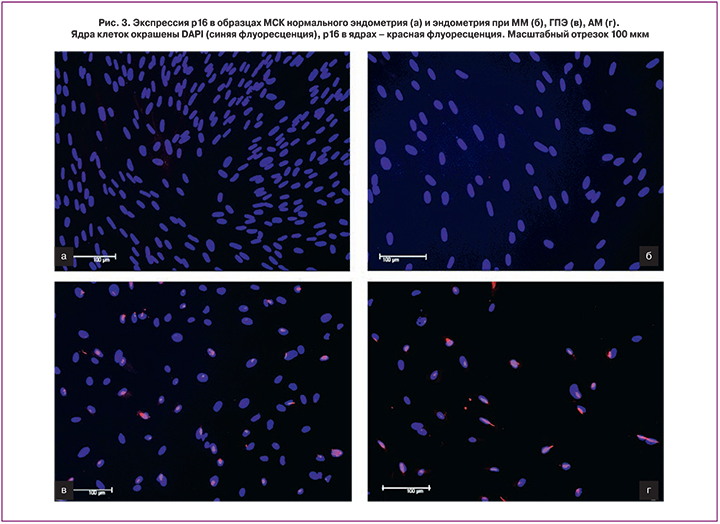
Анализ экспрессии маркеров клеточного цикла позволил выявить разницу между клетками патологического и нормального эндометрия. Так, анализ образцов МСК эндометрия, окрашенных антителами против р16 – одного из белков-ингибиторов клеточного цикла, показал, что в норме и при ММ этот белок отсутствует, в то время как при ГПЭ и АМ его экспрессия была обнаружена во всех исследованных образцах (рис. 3).
Анализ образцов клеток, окрашенных антителами против рецептора c-Met (протоонкоген, рецептор фактора роста гепатоцитов HGF), напротив, выявил присутствие этого рецептора на клетках, выделенных из нормального эндометрия и эндометрия больных с ММ. На клетках, выделенных из эндометрия остальных групп (ГПЭ и АМ), этого рецептора не обнаружено (рис. 4).
Анализ других ключевых маркеров, таких как р53 и PTEN, экспрессия которых по данным других авторов сопровождает изменения нормальной ткани и, в частности, эндометриальной ткани [16, 17], не выявила различий в уровне их экспрессии клетками исследованных групп. Наши исследования показали, что оба эти маркера экспрессируются во всех клетках, как в норме, так и при исследованных патологиях. Разницы в теломеразной активности выявлено не было. Во всех исследованных образцах была обнаружена положительная окраска антителами против теломеразы. Анализ пролиферативной активности с помощью антител против Ki-67 также не выявил разницы среди популяций МСК, выделенных из нормального эндометрия и эндометрия при ММ, ГПЭ и АМ. Во всех случаях была обнаружена положительная окраска в ядрах клеток.
Таким образом, из этой части исследования можно сделать вывод, что существует разница между исследованными образцами нормального эндометрия и эндометрия при ММ, ГПЭ и АМ по экспрессии двух маркеров – протоонкогена c-Met и ингибитора клеточного цикла p16.
На сегодняшний день считается, что одной из возможных причин заболеваний эндометрия являются патологические изменения в компартменте МСК [3–8, 18–20]. В этой связи для выявления возможных причин и разработки новых подходов к диагностике и лечению пролиферативных заболеваний эндометрия приоритетными являются исследования, направленные на изучение фенотипических и функциональных особенностей МСК эндометрия и определение их роли в развитии патофизиологических процессов в матке.
Поскольку получение биопсий для иммуногистохимического анализа широкого спектра маркеров представляет определенные технические сложности, ранее нами была разработана методика выделения и культивирования клеток из небольших фрагментов ткани эндометрия без использования ферментативной обработки. Было показано, что выделяемые описанным методом клетки нормального эндометрия и эндометрия пациенток с ГПЭ, ММ, АМ экспрессируют маркеры CD73, CD105 и CD90, характерные для МСК, и не экспрессируют маркеры клеток гематопоэтического ряда CD34 и CD45 [12]. Кроме того, была подтверждена способность выделенных клеток дифференцироваться в соответствующих условиях в адипогенном, остеогенном и хондрогенном направлениях, что позволяет утверждать, что выделяемая популяция соответствует МСК [13].
Известно, что стромальные клетки играют существенную роль в патологических процессах. Взаимодействуя с другими клетками, входящими в состав ткани, а также реагируя на гормональные стимулы и цитокины, они способны изменять свою функциональную активность, способствуя развитию или тормозя патологический процесс [21, 22].
В целом ряде работ было высказано предположение о важном диагностическом и прогностическом значение uPAR и uPA при малигнизации эндометрия и опухолевой прогрессии [23–26]. Показано, что малигнизация тканей может сопровождаться изменением характера экспрессии этих двух ключевых компонентов, регулирующих пролиферативные и инвазивные процессы. В данной работе анализировали экспрессию uPA и ее рецептора в МСК в норме и при пролиферативных нарушениях. Мы обнаружили, что uPA экспрессируется в МСК как нормального эндометрия, так и в клетках, выделенных из эндометрия при пролиферативных заболеваниях, таких как ГПЭ, ММ и АМ. Вместе с тем в исследованных образцах эндометрия в норме и при патологии экспрессии uPAR выявлено не было. Полученные данные позволяют предполагать, что урокиназная система в эндометриальных МСК не играет решающей роли в развитии заболевания при выбранных патологиях.
Другой исследованный в работе маркер – Т-кадгерин также является одним из прогностических при оценке степени опухолевой прогрессии [27]. Показано, что экспрессия снижается при озлокачествлении опухолей кожи [14] и прогрессии меланомы [15]. Рядом авторов было предположено, что Т-кадгерин функционирует как фактор опухолевой супрессии: снижение его экспрессии в результате аллельной потери или гиперметилирования промотора гена связаны с ростом и метастазированием некоторых типов опухолей [27, 28]. Подавление экспрессии Т-кадгерина коррелирует со злокачественностью фенотипа при раке молочной железы, легких и желчного пузыря [14]. Было высказано предположение о том, что снижение экспрессии этого белка клетками опухоли коррелирует со скоростью роста, инвазивной способностью клеток опухоли и активацией опухолевой стромы [14, 15]. Мы не обнаружили снижения экспрессии этого белка в МСК при пролиферативных заболеваниях эндометрия по сравнению с клетками, выделенными из нормального эндометрия, что может свидетельствовать об отсутствии опухолевой трансформации. По существующим представлениям заболевания матки, связанные с избыточной пролиферацией клеток эндометрия, такие как ГПЭ и АМ, а также ММ не относятся к онкологическим заболеваниям. С другой стороны, избыточная пролиферация может быть первой ступенью на пути трансформации клеток, а поиск причин нарушения регуляции пролиферативного цикла – важным этапом исследования при изучении механизмов развития исследованных патологий эндометрия.
Белок р16 является регулятором клеточного цикла, блокирующим переход клетки из пресинтетической G1 фазы в S фазу (синтеза ДНК), что обеспечивает контроль клеточной пролиферации [30]. Характер экспрессии р16 различен в нормальных тканях и злокачественных образованиях, этот белок является опухолевым супрессором, потеря его экспрессии приводит к потере контроля над клеточной пролиферацией. Известно, что при развитии неоплазий в тканях p16 играет важную роль [31], изменение его экспрессии коррелирует с опухолевым ростом, что было показано на примере заболеваний предстательной железы и, по мнению авторов, может быть использовано в качестве прогностического маркера опухолевой прогрессии [32]. В нашей работе, используя иммунофлюоресцентный анализ, мы установили, что белок p16 экспрессируется в ядрах МСК при АМ и ГПЭ, в отличие от МСК контрольного эндометрия и эндометрия при ММ. Такие результаты согласуются с опубликованными данными о том, что повышение экспрессии p16 наблюдается в тканях в предраковых состояниях, где он, предположительно, сдерживает опухолевую прогрессию [33, 34]. В эндометрии, согласно данным литературы, повышение экспрессии маркера p16 прослеживается в ряду пролиферирующий эндометрий – гиперплазия эндометрия – рак эндометрия [35]. В настоящем исследовании в группе с ГПЭ, куда вошли пациентки с полипами эндометрия и простой гиперплазией без атипии, различий в экспрессии маркера p16 в эндометриальных клетках этих двух типов заболеваний с характерными гиперпластическими изменениями выявлено не было. Таким образом, суммируя данные, полученные при исследовании экспрессии p16 в клетках всех групп, можно сделать предположение о том, что его появление происходит при увеличении пролиферативной активности МСК в ходе развития АМ и при гиперпластических процессах в эндометрии, что, возможно, отражает его защитную функцию в клетках стромы.
По-видимому, процессы избыточной пролиферации в клетках эндометрия коррелируют и с потерей экспрессии рецептора HGF – c-Met. Ранее была продемонстрирована экспрессия c-Met в репродуктивном тракте в овариальных, стромальных и гладкомышечных клетках, а также есть данные о повышение экспрессии c-Met в стромальных клетках эктопических очагов при эндометриозе яичников [36]. В ряде других исследований было отмечено повышение уровня экспрессии c-Met в органах репродуктивной системы при развитии злокачественных опухолей эндометрия и яичников [1, 37]. В литературе существует мнение о том, что взаимодействие пары HGF с c-Met на эпителиальных и стромальных клетках аутокринно стимулирует прогрессию эндометриоза [1]. Таким образом, изменение экспрессии c-Met может являться способом регуляции чувствительности клеток к HGF – одному из основных протоонкогенов. Полученные нами результаты об экспрессии c-Met на поверхности МСК эндометрия в норме и при ММ, а также его исчезновение при АМ и ГПЭ позволяют предполагать его возможное участие в пролиферации и инвазии клеток эндометрия в ходе развития исследованных патологий.
Заключение
В настоящей работе были получены новые данные об экспрессии белков-регуляторов пролиферации и клеточного цикла в МСК нормального эндометрия и эндометрия при заболеваниях тела матки. В ходе исследований была выявлена разница в экспрессии белков р16 и с-Met клетками, выделенными из нормального эндометрия и ММ, по сравнению с клетками, выделенными из эндометрия при ГПЭ и АМ. Мы предполагаем, что эти белки имеют важное значение в регуляции пролиферации и функционировании МСК нормального эндометрия и МСК при его патофизиологических изменениях. Изменение экспрессии этих маркеров имеет потенциальное диагностическое значение и указывает на их возможное участие в регуляции пролиферации в компартменте стволовых клеток эндометрия.



