Наружный генитальный эндометриоз (НГЭ) занимает ведущее место в структуре гинекологической патологии [1]. По данным Всемирного исследовательского фонда эндометриоза (WERF), каждая десятая женщина репродуктивного возраста в мире страдает эндометриозом (около 176 млн женщин в возрасте от 17 до 49 лет). В последнее время отмечается неуклонный рост частоты данной патологии [1].
Эндометриоз – патологическое разрастание ткани, по структурным и функциональным свойствам подобной эндометрию, за пределами слизистой оболочки матки, характеризующееся рецидивирующим течением [2]. В соответствии с данными современной литературы, этиология и патогенез эндометриоза до сих пор остаются не изученными. Эндометриоз относится к гиперпластическим процессам, в основе которых лежит повышенная способность клеток к делению и устойчивость к апоптозу [3]. В соответствии с данными Vinatier [4], в патогенез эндометриоза вовлечены следующие молекулярные процессы: рефлюкс клеток эндометрия [4], их адгезия [5], протеолиз [6], усиленная пролиферация [3], ангиогенез [7] и фиброгенез [8]. В норме каждый из этих механизмов контролируется защитными системами клеток и органов, однако у больных эндометризом этого не происходит [4]. В частности, авторами Watanabe [5] и Gebel [6] было продемонстрировано угнетение апоптоза в клетках эутопического эндометрия пациенток с эндометриозом по сравнению с контрольной группой, а также тенденция к снижению апоптоза с возрастанием стадии патологического процесса. Более того, по мнению ряда авторов [3, 7], устойчивость эндометриальных клеток к апоптозу признается пусковым механизмом в развитии заболевания. В стимуляции апоптоза в позднюю секреторную и менструальную фазы цикла принимают участие белки Fas/FasL [6–8] и фактор некроза опухоли (TNF)-α [9]. В пролиферативную фазу менструального цикла активация белка Bcl-2 [5], эстрогеновых и прогестероновых рецепторов [9], наоборот, препятствует передаче апоптических сигналов и запуску запрограммированной гибели клеток.
В развитии дисбаланса между апоптозом и клеточной пролиферацией могут участвовать липиды [10]. Так, нарушение сигнальной функции таких липидов, как фосфотидилхолины и сфингомиелины, может рассматриваться как важнейшее событие, приводящее к угнетению апоптоза, генетическим дефектам, гиперпластическим процессам (вплоть до развития злокачественных новообразований) [10, 11]. Поэтому изучение роли компонентов липидов в регуляции клеточного деления при эндометриозе является актуальным и в дальнейшем может служить основой для поиска диагностических маркеров и новых методов терапии.
На данный момент было предложено более 100 потенциальных маркеров эндометриоза, однако ни один из них не показал достаточной диагностической значимости [12]. До сих пор поиск маркеров развития/агрессивности эндометриоза ограничивался таргетным изучением определенных метаболитов, в частности метаболитов арахидоновой кислоты и стероидов [12]. Исследования всего набора липидов в тканях и плазме крови при эндометриозе очень ограничены. Скрининг целого класса веществ, в том числе липидов, является основной прерогативой метода масс-спектрометрии [13].
Цель данной работы: оценка перспективности применения метода прямой масс-спектрометрии для сравнительного анализа молекулярного состава тканей эктопического и эутопического эндометрия. Изменение липидома тканей эндометрия при эндометриозе отражает патологические процессы неконтролируемой и атипичной инвазии и инфильтративной пролиферации эндометрия в эктопических участках. Предполагается также целесообразным определение концентрации возможных липидных маркеров в крови с целью разработки неинвазивного теста для диагностики эндометриоза и прогноза степени агрессивности патологического процесса.
Материал и методы исследования
Клиническая характеристика больных
В данное исследование по типу «случай-контроль» включены 30 пациенток с эндометриоидными кистами яичников и перитонеальным эндометриозом, проходивших лечение на базе ФГБУ Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова Минздрава России. Протокол исследования был одобрен Этическим комитетом. От каждого участника исследования было получено письменное информированное согласие.
Диагноз НГЭ был верифицирован на этапе клинико-инструментального обследования, включая лечебно-диагностическую лапароскопию, и окончательно подтвержден гистологически. Всем пациенткам была произведена лапароскопия, в ходе которой устанавливались степень распространения НГЭ, локализация и размер эндометриоидных гетеротопий, а также выраженность спаечного процесса. На момент проведения оперативного вмешательства 50% женщин находились в пролиферативной и 50% женщин – в секреторной фазах менструального цикла. В данном исследовании использовалась классификация Американского общества фертильности (1979), согласно которой, все пациентки имели III–IV стадию НГЭ.
Обязательными критериями включения являлись: репродуктивный возраст женщин, отсутствие гормональной терапии в течение 6 месяцев до операции, отсутствие воспалительных заболеваний органов малого таза и тяжелой соматической патологии.
Возраст пациенток варьировал от 22 до 41 года (средний возраст – 31,5 года).
При поступлении в стационар более половины женщин (60%) предъявляли жалобы на хроническую тазовую боль (18 пациенток); 26,6% женщин страдали дисменореей (8 пациенток); 6,6% женщин отмечали диспареунию (2 пациентки). Почти каждая вторая женщина (43,3%) страдала первичным бесплодием (13 пациенток), вторичное бесплодие отмечалось только у 2 женщин (6,6%). Невынашивание беременности выявлено в анамнезе у 5 женщин (16,6%). Каждая пятая пациентка (20%) жаловалась на нарушение менструального цикла по типу меноррагии, 2 пациентки – на нарушение менструального цикла по типу метроррагии (6,6%) и 3 – на мажущие выделения по типу «менструальной мазни» после менструации (10%). По данным ультразвукового исследования (УЗИ) и/или магнитно-резонансной томографии до операции эндометриоидные кисты яичников и глубокий инфильтративный эндометриоз были выявлены в 100% случаев. Поверхностные перитонеальные очаги диагностировались только в процессе лапароскопической операции.
Согласно УЗИ органов малого таза и лапароскопии, только у 66,6% женщин отсутствовала сопутствующая гинекологическая патология. У 6 из 30 женщин был диагностирован аденомиоз, у 4 женщин – миома матки.
Сбор образцов
Все образцы тканей были получены в отделении оперативной гинекологии ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России во время хирургических операций. Биоптаты перитонеальных эндометриоидных очагов после иссечения (без термического воздействия), капсулы эндометриоидных кист после цистэктомии, эндометрий после диагностического выскабливания полости матки помещали в отдельные стерильные пробирки (1 мл) и погружали в жидкий азот. Далее образцы транспортировали в лабораторию, где хранили при температуре –80 °С. Каждый образец ткани был разделен на две части: для патоморфологического исследования и для прямой масс-спектрометрии.
Прямой масс-спектрометрический анализ
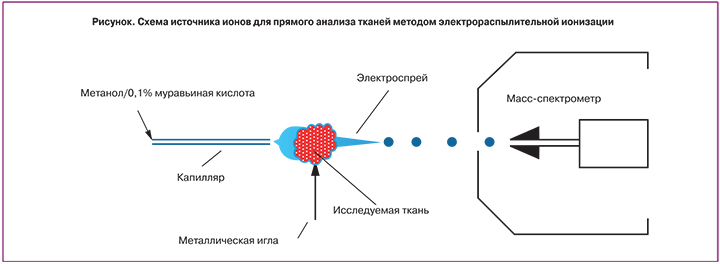
Анализ молекулярного состава тканей проводили методом спрея с ткани – разновидности электрораспылительной ионизации. В этом методе кусочек ткани порядка 10–20 мг помещается непосредственно в источник ионов. На ткань подается постоянный поток растворителя, в данном исследовании это был 0,1% раствор муравьиной кислоты в метаноле (рисунок). Между тканью и входом в масс-спектрометрический анализатор прикладывается разность потенциалов 2900 В, при этом в режиме реального времени происходит экстракция веществ метанолом и их последующая десорбция/ионизация под действием высокого напряжения. Метод позволяет получать высокоинформативные масс-спектры веществ, содержащихся в тканях, с минимальной предварительной обработкой. Все масс-спектры были получены в режиме положительных ионов на квадрупольном времяпролетном масс-спектрометре (Maxis Impact, Bruker, Germany).
Идентификация липидов и статистический анализ
Масс-спектры были проанализированы с помощью ряда функций, разработанных на языке R. Информация об интенсивности пиков (m/z) масс-спектра каждого образца ткани использовалась для многомерного анализа данных (MDA) методом дискриминантного анализа частичных наименьших квадратов (PLS-DA)
с последующей группировкой пиков [14]. Перед MDA выполнялось масштабирование по Парето [15]. Вариабельность пиков, позволившая дифференцировать различные ткани, была определена согласно результатам PLS-DA метода. Молекулы, соответствующие полученным масс-спектрометрическим пикам, идентифицировались по точной массе (точность масс-спектрометрических данных – 5–10 ppm) и спектрам фрагментации (МС/МС).
Результаты
Участки ткани эндометрия, полученные при биопсии, были проанализированы с помощью метода прямой масс-спектрометрии для определения различий молекулярного состава эктопического и эутопического эндометрия. Полученная информация (масс-спектрометрические данные) обрабатывалась методами MDA для выяснения возможности создания классификации, основанной на данных, полученных в ходе прямой масс-спектрометрии и выявления молекул, обусловливающих различие тканей. PLS-DA является модификацией метода анализа главных компонент, направленной на выявление различий между изучаемыми группами.
Было показано, что исходя из данных, полученных с помощью прямой масс-спектрометрии, и применяя метод PLS-DA, можно отличить эктопические участки от эутопической ткани. При построении PLS-DA модели были выделены две компоненты, позволяющие отличить эндометриоидную кисту яичника от эутопического эндометрия, и четыре компоненты для перитонеального эндометриоза и эутопического эндометрия. Созданная статистическая модель при анализе эндометриоидной кисты яичника и эутопического эндометрия позволяет описать 80% данных с использованием латентных переменных (R2). По результатам перекрестной проверки значение Q2 для модели составило 66%. Данная величина показывает ожидаемую точность прогнозирования новых данных. У модели для перитонеального эндометриоза и эутопического эндометрия соответствующие величины составили R2=94%, Q2=83%, что говорит о высокой значимости и возможной диагностической ценности модели. Анализ важности независимых переменных в проекции (VIP), полученные в PLS-DA моделях выявил 15 компонентов, наиболее существенных для создания фенотипической классификации в исследовании. Идентификация этих компонентов проводилась в соответствии с их точными массами и МС/МС спектрами. Важно заметить, что большинство из выявленных методом прямой масс-спектрометрии веществ являются липидами, и определение различий в их экспрессии достаточно, чтобы отличить эктопический эндометрий от эутопического.
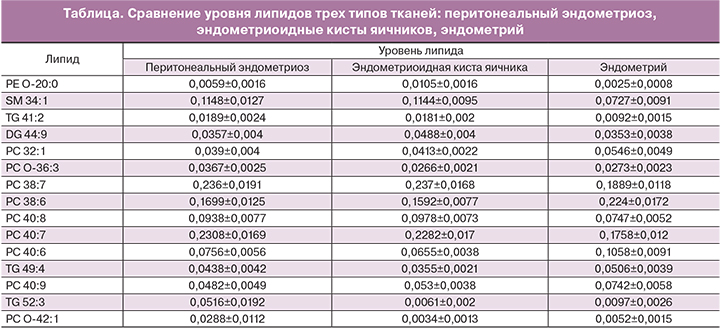
В таблице приведены уровни липидов трех типов тканей: эндометриоидных тканей (эндометриоидные кисты яичников и перитонеальные очаги эндометриоза) и эутопического эндометрия, а именно фосфоэтаноламин (PE O-20:0), сфингомиелин (SM 34:1), диглицериды (DG 44:9), фосфатидилхолины (PC 32:1, PC O-36:3, PC 38:7, PC 38:6, PC 40:8, PC 40:7, PC 40:6, PC O-42:1), триглицериды (TG 41:2, TG 49:4, TG 52:3). В эндометриоидных тканях был значительно повышен уровень сфингомиелина SM 34:1, фосфоэтаноламина PE O-20:0, триглицерида TG 41:2 и нескольких фосфатидилхолинов – PC 38:7, PС 40:8, PC 40:7. Уровень фосфатидилхолинов PC 38:6, PC 40:6, PC 40:9, PC 32:1 был выше в эутопическом эндометрии, чем в эктопическом. Более чем 70% выявленных липидов включают в свой состав полиненасыщенные жирные кислоты. Доказано, что некоторые ненасыщенные жирные кислоты обладают способностью стимулировать пролиферацию опухолевых клеток молочной железы человека, в то время как некоторые насыщенные жирные кислоты, напротив, ингибируют усиленный рост клеток и повышают скорость апоптоза [16].
Содержание фосфолипида PC O-42:1 и триглицерида TG 52:3 оказалась в среднем в 10 раз выше в перитонеальных очагах, чем в капсулах эндометриоидных кист и ткани эндометрия. Это можно объяснить тем, что при иссечении перитонеальных очагов во время хирургических операций в биоптаты попадало небольшое количество жировой ткани (жировые клетки, как известно, на 85% состоят из триглицеридов). Для большинства липидов, содержание которых достоверно различалось в эктопическом и эутопическом эндометрии, не было выявлено существенных различий в их содержании между тканью эндометриоидной кисты и эндометриоза брюшины. Таким образом, данные липиды являются специфичными именно для эндометриоидного процесса, а не для ткани брюшины или яичника.
Обсуждение
Согласно данным ряда исследований, в ответ на различные патофизиологические стимулы (внешние или генетические сигналы) в организме человека закономерно изменяются показатели клеточного метаболизма, в частности липидный спектр тканей. Тем не менее, в сфере изучения патогенеза эндометриоза данная особенность исследована в весьма ограниченном количестве научных работ [10]. Липиды играют неотъемлемую роль в развитии фундаментальных реакций, лежащих в основе практически любого патологического процесса, в частности воспаления, оксидативного стресса, пролиферации, ангиогенеза [17]. В связи с тем, что все вышеперечисленные молекулярные механизмы вовлечены в патогенез эндометриоза, представляет большой интерес определение роли липидов в инициации, развитии и прогрессировании данного заболевания.
В данной работе были выявлены липиды трех классов, которые могут быть предложены к качестве потенциальных биомаркеров эндометриоза, а именно: сфинголипиды, глицерофосфолипиды, ди- и триглицериды.
Сфинголипиды
Сфингомиелин относится к классу сфинголипидов, входит в состав клеточных мембран [18]. В данное время появляется все больше сведений о том, что сфинголипиды являются важными биоактивными сигнальными молекулами и участвуют в различных клеточных процессах. Сфингомиелин синтезируется de novo в эндоплазматическом ретикулуме. В результате гидролиза под действием сфингомиелиназ из сфингомиелина высвобождается церамид (Cer), который в дальнейшем расщепляется церамидазой на сфингозин и жирную кислоту [17]. Cer и сфингозин играют важную роль в сигнальной трансдукции, регулируют клеточную пролиферацию, ангиогенез и миграцию клеток. Например, Cer и сфингозин индуцируют каспазы апоптоза, в то время как их фосфорилирование или гликозилирование приводит к образованию митогенных факторов, таких как Cer-1-фосфат (C1P), сфингозин-1-фосфат (S1P) и глюкозилцерамид (GlcCer) [18]. Было выявлено, что при эндометриозе повышается активность генов киназ сфингозина (ENPP7, ACER1, SPHK1), которые катализируют реакции фосфорилирования и образования S1P. В то же время снижается активность фосфатаз (гены SGPP1, PPAP2A), катализирующих обратную реакцию, что ведет к значительному возрастанию, по сравнению с нормой, концентрации S1P [19]. Взаимодействуя с рецепторами, сцепленными с G-белками (S1PR1, S1PR2, S1PR3, S1PR4, S1PR5), сфингозин-1-фосфат за счет активации целого ряда внутриклеточных каскадов реакций (MAPK, фосфолипаза C, PI3 киназы) усиливает пролиферативный потенциал клеток, обеспечивает их устойчивость к апоптозу, стимулирует ангиогенез, клеточную миграцию [10]. Под влиянием S1P усиливаются местные окислительные процессы в эндометрии, повышается концентрация активных форм кислорода. S1P стимулирует экспрессию местными иммунными клетками TNF-α и интерлейкина (IL)-8,
которые в свою очередь активизируют COX2 и синтез простагландинов [20]. Простагландины же принимают участие в развитии болевого синдрома и бесплодия при эндометриозе [20]. Высокий уровень сфинголипидов в нервной ткани предполагает их участие в межнейрональных, нервноэндокринных и нервномышечных связях. В частности, в эктопическом эндометрии, продолжающиеся процессы денервации с последующей реиннервацией вызваны повышением уровня сфингомиелинов и, по всей видимости, являются одной из причин развития болевого синдрома [10].
Фосфолипиды
В данном исследовании выявлены повышенные уровни различных подклассов фосфолипидов у больных с эндометриозом, которые участвуют в регуляции различных внутриклеточных процессов, таких как транскрипция, сигнальная трансдукция, транспорт веществ [21].
Фосфатидилхолины PC – один из важнейших подклассов фосфолипидов, компонент плазматических мембран и мессенджер клеточной сигнализации. PC является субстратом для фосфолипазы А2 (PA2) – фермента, экспрессия которого усиливается в эндометриоидных очагах [10]. Под действием РА2 из PC образуется лизофосфатидная кислота (LCA) [22]. Взаимодействуя с рецепторами, связанными с G-белками (рецепторы LPАR1-6), а также ядерным рецептором PPARγ, LCA регулирует клеточную пролиферацию, дифференцировку, индуцирует морфологические изменения клеток, а также их миграцию [22]. Отмечено, что в органах репродуктивной системы, в частности в яичниках и эндометрии, наиболее характерно присутствие рецептора LPAR3, экспрессия которого снижается в среднюю и позднюю секреторную фазы менструального цикла у пациенток с эндометриозом. Понижение уровня LPAR3, наряду с другими маркерами рецептивности эндометрия (HOXA10, остеопонтин, гликоделин А) ведет к нарушению имплантационного потенциала эндометрия, следовательно, к бесплодию, ассоциированному с эндометриозом [23]. В то же время отмечается, что LCA изменяет местную иммунную реактивность в тканях, повышая активность лимфоцитов, моноцитов, усиливает экспрессию MCP-1, IL-6, IL-8 и факторов роста. Способность данной молекулы стимулировать COX2 ведет также к локальному накоплению простагландинов (преимущественно PGE2), об эффектах которых было упомянуто выше, а индукция матриксной металлопротеиназы (MMP)-7 сопровождается изменениями архитектоники тканей, провоцирующими прогрессивный рост, инвазию патологического процесса [24].
Фосфоэтаноламин PE является липидом цитоплазматического слоя клеточных мембран. Фосфоэтаноламин-цитидилтрансфераза играет ключевую роль в производстве PE плазмалогенов, уровень которых снижен у больных раком яичников и печени [25]. Синтетические алкил-фосфолипиды участвуют в множестве клеточных процессов, в том числе в обмен фосфолипидов и передаче сигналов, поэтому их первичной мишенью в терапии злокачественных новообразований является плазматическая мембрана, а не ядерная ДНК (как при химиотерапии) [26]. Синтетический PE способен ингибировать рост раковых клеток [26]. Механизм этого эффекта полностью не изучен. Тем не менее, было показано, что этот метаболит фактически полностью подавляет митохондриальное дыхание, что может быть связано с противоопухолевым эффектом.
Ди- и триглицериды
Роль диацилглицеридов (DG) в метаболизме глицеролипидов имеет первостепенное значение. DG являются предшественниками многих липидов, таких как фосфатидилхолины, фосфоэтаноламины, триацилглицериды [27]. Кроме того, DG играют важную роль в передаче сигналов от глицеролипидов через активацию протеинкиназы С, которая в свою очередь участвует в процессах дифференцировки и пролиферации клеток [28].
Действие DG при апоптозе обратно эффекту церамида, что свидетельствует об их защитной функции против неконтролируемой пролиферации трансформированных клеток [27]. Так, устойчивые изменения в уровнях церамида и диацилглицерола приводят к длительному или даже постоянному перепрограммированию функции клеток посредством регуляции апоптоза и механизмов клеточного цикла [29]. TNF-α, Fas-лиганд, радиация или химиотерапевтические агенты вызывают накопление церамида в клетках [8, 9]. Активация DG протеинкиназы С защищает клетки от различных апоптотических повреждений, вследствие чего можно предположить, что церамид-опосредованная протеинкиназа С является препятствием на пути к апоптозу [28]. Исследования на различных клетках показали, что активация протеинкиназы С стимулирует активность сфингозинкиназы и этот эффект опосредован сфингозин-1-фосфатом [18]. DG опосредуют агонист-индуцированную стимуляцию роста и пролиферации клеток, в то время как церамиды способствуют передаче сигналов от агонистов, активных в антипролиферативных процессах [16, 18]. Нарушение соотношения диацилглицерол/церамид может привести к ненормальным клеточным реакциям и вызвать злокачественные онкологические заболевания, преждевременный процесс старения и предположительно эндометриоз [30].
Заключение
Полученные результаты свидетельствуют о том, что при эндометриозе уровень сфинго- и фосфолипидов повышен, что может приводить к подавлению апоптоза и влиять на липидно-опосредованные пути передачи пролиферативных сигналов в клетку. Применение метода прямой масс-спектрометрии позволяет, наряду с дифференцировкой тканей, выявить характерные для НГЭ липидные паттерны, которые могут быть предложены в качестве возможных биомаркеров прогрессирования и раннего рецидива данной патологии.
Таким образом, липидомный анализ эндометриоидных тканей может иметь первостепенное значение для описания механизмов, вызывающих усиленный рост клеток, характерный для агрессивной формы эндометриоза. Разработка агентов, действующих прицельно на эти молекулярные процессы, может привести к созданию новых лекарственных средств и методов терапии эндометриоза.



