Проблема изучения патогенеза миомы матки не теряет актуальность уже в течение многих лет. Ее распространенность среди женщин репродуктивного возраста, по данным многих авторов, колеблется от 10% до 30% относительно всех гинекологических заболеваний. Кроме того, миома матки занимает лидирующее место по частоте встречаемости среди опухолей женской половой сферы [1–4].
Лейомиома является доброкачественной, хорошо ограниченной, капсулированной опухолью, которая развивается из мезенхимальной гладкомышечной ткани и имеет моноклональное происхождение [5].
Один из патогенетических аспектов роста лейомиомы заключаются в процессах неоангиогенеза, регуляция которого происходит под воздействием ангиогенных факторов, как ингибиторов, так и активаторов этого процесса. В растущих миоматозных узлах выявляют повышенную скорость аэробного и анаэробного гликолиза, высокий уровень пролиферации в лейомиоцитах, увеличение экспрессии факторов роста и ингибиторов апоптоза [6]. Рост лейомиомы, как и любой другой опухоли, зависит от баланса между процессами пролиферации и апоптоза и может быть как результатом повышения пролиферации, так и уменьшения скорости гибели клеток путем апоптоза [6–8].
В настоящее время продолжается дискуссия относительно лучшего способа лечения лейомиомы тела матки у женщин репродуктивного возраста. Современная тактика ведения больных с миомой матки включает наблюдение, медикаментозную терапию, различные методы хирургического воздействия (миомэктомия, гистерэктомия), а также альтернативные методы лечения. К последним относят эмболизацию маточных артерий (ЭМА) и фокусированную ультразвуковую аблацию под контролем магнитно-резонансной томографии (ФУЗ-МРТ аблация). Метод ЭМА заключается во введении эмболизирующего вещества в ветви маточной артерии, кровоснабжающие миоматозный узел, при помощи специального проводника через доступ в бедренной артерии. При проведении ФУЗ-МРТ аблации происходит облучение, и как следствие нагревание миоматозного узла фокусированным ультразвуком, процедура проводится под контролем МРТ. Следствием первой методики является развитие ишемического некроза миоматозных узлов, а второй – развитие коагуляционного некроза. В связи с внедрением новых методик лечения, а также с целью оценки их эффективности, исследователей интересует влияние вышеописанных методик на структурные и молекулярно-биологические особенности миоматозных узлов.
Целью нашего исследования стало изучение клинико-морфологических и иммуногистохимических особенностей лейомиомы тела матки у женщин репродуктивного возраста после ранее перенесенной ЭМА, ФУЗ-МРТ аблации миомы и миомэктомии.
Материал и методы исследования
На базе ФГБУ НЦАГиП им. В.И. Кулакова в период с 2012 по 2015 гг. было проведено комплексное клинико-морфологическое исследование. В исследование вошли 85 женщин в возрасте от 22 до 45 лет, средний возраст составил 36,2±5,2 года. I группу составили 29 пациенток после ранее перенесенной ЭМА, II группу – 26 пациенток после ранее перенесенной ФУЗ-МРТ аблации и III группу – 30 пациенток после ранее проведенной миомэктомии. Гистологическое и иммуногистохимическое исследование выполняли на операционном материале миоматозных узлов, полученных в ходе органосохраняющих миомэктомий в фазу секреции. Лапароскопические и лапаротомические миомэктомии выполняли по стандартным методикам в отделении оперативной гинекологии с последующей оценкой ситуации в зоне оперативного вмешательства и послеоперационного течения.
В исследование были включены пациентки с множественной лейомиомой тела матки, общие размеры соответствовали сроку беременности от 7 до 26 недель. Наиболее часто размеры матки соответствовали 7–10 неделям – 8 (27,5%) в I группе, 10 (38,5%) – во II группе, 15 (50,0%) – в III группе.
От каждой пациентки брали от 3 до 7 образцов ткани лейомиомы, материал фиксировали в 10% растворе нейтрального формалина и по общепринятой методике заливали в парафин. Далее проводили окрашивание гистологических срезов гематоксилином и эозином. Для иммуногистохимического исследования готовили парафиновые срезы толщиной 4 мкм, которые наносили на высоко адгезивные стекла и держали в термостате при температуре 37°С в течение 18 часов. Проводили стандартное иммуногистохимическое исследование (Daco protocols) с термической демаскировкой антигенов. В исследовании использовались антитела к Ki-67 (clone MIB-1, Dako, Denmark, 1:100), сосудисто-эндотелиальному фактору роста (VEGF) (clone ab1316, 1:100, Abcam), инсулиноподобному фактору роста (IGFR-1) (polyclonal rabbit antibody, 1:600, GeneTex), фактору, индуцируемому гипоксией (HIF1alpha) (clone EP215Y, rabbit monoclonal antibody, 1:300, GeneTex), Caspase 3 (clone 31A1067, mouse monoclonal antibody, 1:100, GeneTex).
Результаты иммуногистохимических реакций оценивались полуколичественным методом в баллах. Оценка экспрессии маркеров (VEGF Casp3, IGFR-1) проводилась по 6-бальной шкале: 2 балла – 20% окрашенных клеток, 4 балла – от 20–40% окрашенных клеток, 6 баллов – более 40% окрашенных клеток. Оценка результатов иммуногистохимических реакций для Ki-67, HIF подсчитывалась в процентах на 1000 клеток одного типа.
Статистическую обработку полученных результатов проводили при помощи статистических программ SPSS 16.0, SPSS: An IBM Company (США) и Statistica 10.0, StatSoft (США). Корреляционный анализ проводился с использованием непараметрического корреляционного критерия Спирмена. Различия между статистическими величинами считали статистически значимыми при уровне достоверности р<0,05.
Результаты и обсуждение
Среди всех клинических симптомов у больных до операции наиболее часто встречался болевой синдром: у 23 (88,5%) пациенток во II группе, у 19 (65,5%) в I группе и у 15 (50,0%) в III группе, что было статистически значимым (р<0,01). Вторыми по распространенности были жалобы на обильные менструации, одинаково часто представленные: у 14 (48,27%) пациенток в группе после ЭМА, у 13 (50,0%) в группе после ФУЗ-МРТ аблации и у 18 (60,0%) в группе после миомэктомии.
Статистически значимо, наиболее крупные по размеру миоматозные узлы встречались в группе пациенток после ЭМА – 9,4±5,8 см, в группе после ФУЗ-МРТ аблации средний размер миоматозных узлов составил 6,9±4,2 см, что практически равнялось показателям группы после миомэктомии – 6,5±5,1 см, р=0,0334. В нашем исследовании у большинства пациенток в группах сравнения была выявлена множественная миома матки, а именно у 20 пациенток (68,9%) после ЭМА, у 15 (57,7%) после ФУЗ-МРТ аблации и у 21 пациентки (70,0%) после миомэктомии.
Пациентки в группах сравнения были сопоставимы по клиническим проявлениям и размеру лейомиомы.
В группе после ЭМА отмечались значительные трудности при вылущивании и удалении миоматозных узлов в связи с наличием конгломератов у 12 (41,4%) пациенток, отсутствием четких границ миомы у 21 (72,4%) женщины, явлением некроза у 18 (62,1%) пациенток, явлениями отека у 14 (48,2%) и наличием дегенеративных изменений у 26 (89,6%), при p<0,05. В группе после ФУЗ-МРТ аблации конгломераты узлов были выявлены у 7 пациенток (26,9%), отсутствие четких границ миоматозных узлов наблюдалось у 5 (19,2%), явления отека были выявлены у 8 (30,8%), явления некроза у 9 (34,6%) пациенток, дегенеративные изменения миоматозных узлов были выявлены у половины пациенток данной группы – 13 (50%).
При морфологическом исследовании выявлено, что все удаленные миоматозные узлы имели строение простой лейомиомы.
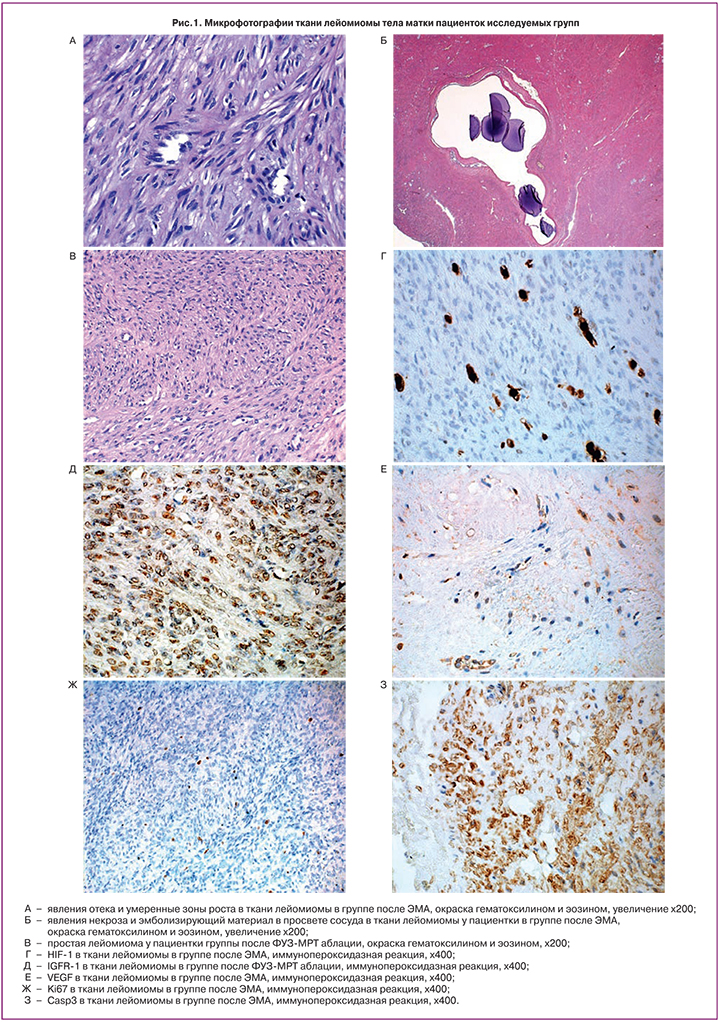
Явления некроза и отека в ткани лейомиомы встречались статистически значимо выше в группе после ЭМА – в 16 (55,2%) и в 13 (44,8%) случаях соответственно (рис. 1А, Б), в группе после ФУЗ-МРТ аблации миомы – в 9 (34,6%) и в 10 (38,5%) случаях и только лишь у одной пациентки (3,3%) и у 2 (16,7%) в группе после миомэктомии.
Таким образом, данные морфологического исследования сопоставимы с результатами, полученными интраоперационнно.
Патогенетически явления некроза обусловлены воздействием альтернативных методов лечения миомы, следствием, которых и является развитие ишемического некроза миоматозных узлов в случаях ЭМА и коагуляционного некроза в случаях ФУЗ-МРТ аблации. Однако, как показало наше исследование, добиться этого удалось далеко не у всех пациенток.
У 3 пациенток (10,3%) в группе после ЭМА и у 1 (3,3%) в группе после миомэктомии были выявлены кровоизлияния в миоматозном узле, что не явилось статистически значимым (р>0,05).
Развитие миом происходит из зон роста, расположенных обычно вокруг тонкостенного сосуда. Изначальные клетки миомы дифференцируются в миофибробласты, которые затем трансформируются в миобласты и фибробласты. Формирование «зон роста» лейомиомы происходит вокруг воспалительных инфильтратов и эндометриоидных эксплантатов в миометрии [5]. В нашем исследовании выраженное количество зон роста было обнаружено только у 4 пациенток (13,8%) после ЭМА. Умеренное количество зон роста было выявлено у 3 пациенток (10,3%) в I группе, у 5 (19,2%) – во II группе и только лишь у 2 пациенток (6,7%) в III группе, p<0,05 (рис. 1А).
Известно, что VEGF играет ключевую роль в развитии как физиологического, так и патологического ангиогенеза [9, 10]. В нашем исследовании были выявлены достоверно значимые различия во всех трех группах сравнения
Экспрессия VEGF в I группе составила 2,7 балла в эндотелии, 1,7 балла в гладкомышечных клетках; в II группе – 1,8 балла в эндотелии, 0,3 балла – в гладкомышечных клетках; в III группе – 3,5 балла в эндотелии, 2,0 балла – в гладкомышечных клетках.
Наибольшая экспрессия VEGF (в эндотелии) наблюдалась по убыванию в группе пациенток после миомэктомии, в группе после ЭМА и в группе после ФУЗ-МРТ аблации, что явилось статистически значимым, р<0,01 (рис. 1Д и 2А).

Одним из основных факторов, вовлеченных в адаптивную реакцию опухоли на клеточную гипоксию, является белок HIF-la, который регулирует семейство генов, включающее гены VEGF, рецептора урокиназы, тирозингидролазы, эндотелина, синтазы оксида азота, эритропоэтина и ряда гликолитических ферментов [11–13]. В нашем исследовании экспрессия HIF-1 была значительно больше в группе после ЭМА – 10,1%, находилась на среднем уровне в группе после миомэктомии – 5,0% и была очень низкой в группе после ФУЗ-МРТ аблации – 0,26%, что явилось статистически значимым, р<0,05 (рис. 1Г и 2Б).
Таким образом, экспрессия HIF-1 достоверно выше в группе пациенток после ЭМА, что патогенетически объяснимо непосредственно фактом эмболизации сосудов, кровоснабжающих узел, приводящей к гипоксии, в условиях которой и происходит активация HIF-1α, который, как известно, является индуктором VEGF. Так происходит запуск каскада последовательных реакций, который приводит к активации VEGF-A. Это подтверждается полученными нами данными, т.к. в этой же группе также отмечалась и повышенная эксперессия VEGF, что позволяет говорить об активации процессов неоангиогенеза в лейомиоцитах. Ангиогенез – это процесс образования новых кровеносных сосудов с несостоятельной стенкой из уже имеющихся. Последний факт подтверждается выявлением большего количества кровоизлияний в данной группе (10,3%). Именно формирование новой системы кровоснабжения позволяет опухоли расти. Процесс неоангиогенеза является необходимым для длительной адаптации тканей в условиях повреждения. Кроме того, новообразованные сосуды являются обязательным компонентом зон роста в лейомиомах, которые чаще обнаруживаются в данной группе (24,1%). В мировой литературе имеются данные о повышении уровня VEGF в плазме пациенток через 30 дней после ЭМА; авторы полагают, что повышенная экспрессия VEGF может иметь негативное влияние на эффективность ЭМА [14]. Данные, полученные при иммуногистохимическом исследовании о повышении экспрессии VEGF в группе после ЭМА, подтверждаются интраоперационными данными об объеме кровопотери, который был статистически значимо наибольшим именно в этой группе пациенток. В группе пациенток после ЭМА этот показатель составил в среднем 625,9±801,2 против 243,5±241,9 в группе после ФУЗ-МРТ аблации и 326,3±346,2 в группе пациенток после миомэктомии. У большей части пациенток во всех трех группах удалось выполнить оперативное вмешательство с общей величиной кровопотери менее 500 мл. Группа после ЭМА явилась единственной, в которой кровопотеря превышала 1500 мл – у 3 пациенток (9,4%).
Также следует отметить, что при проведении операции пациенткам группы после ЭМА на поверхности миоматозных узлов встречались аномальные извитые сосуды с тонкой стенкой, а также расширенные капилляры, которые, вероятно, представляли собой реканализированные сосуды, либо коллатеральный кровоток.
В группе после миомэктомии мы наблюдаем повышенную экспрессию VEGF, в особенности в эндотелии, при среднем уровне экспрессии HIF-1.
Это объясняется тем, что у пациенток данной группы удаленные узлы миомы являлись вновь образованными и интактными от предшествующего лечения, поэтому, кровоснабжение и транспорт кислорода в них не страдали. По исследованиям E.T. Uluer было доказано, что не только HIF-1 альфа может являться активатором VEGF. Так, его индукция возможна при участии RAS, NF-кВ, COX2 и др. [10]. Таким образом, причина повышенной экспрессии VEGF и ее активаторов у пациенток с рецидивом миомы подлежит дальнейшему изучению. При проведении корреляционного анализа, нами была выявлена положительная корреляция между уровнем HIF-1 и VEGF в эндотелии в исследуемых группах (r=0,4399, p=0,000025 (<0,0001)).
Напротив, в группе после ФУЗ-МРТ аблации отмечается снижение экспрессии HIF-1 и VEGF, что говорит об отсутствии активации процесса неоангиогенеза и возможном их ингибировании, связанном с лучевым воздействием. Этот аспект может иметь положительный эффект относительно уменьшения в размерах миоматозных узлов.
IGFR-1 выявлялся в цитоплазме гладкомышечных клеток лейомиоцитов; в I группе экспрессия IGFR составила 1,5 балла; в II группе – 3,6 балла; в III группе – 2,7 балла, р<0,05. Максимальная его экспрессия была выявлена во II группе (рис. 1Д и 2Г).
IGFR-1 наряду с другими факторами роста, вовлечен в формирование и рост миомы матки и по данным некоторых исследований бывает повышен в ткани лейомиомы. Рецепторы к IGFR-1 расположены на гладкомышечных клетках миометрия и миомы матки [15]. Можно предположительно говорить о повышенной выработке IGFR-1, за счет чего и может быть отмечен рост узлов лейомиомы у пациенток группы после ФУЗ-МРТ аблации.
Регуляция роста любой опухоли отражает баланс между процессами пролиферации и апоптоза [7].
Экспрессия Ki67 в ядрах гладкомышечных клеток лейомиоцитов в I группе составила в среднем 2,6%, во II группе – 1,8% и в III группе – 3,8%, р<0,05. Таким образом, наибольшая экспрессия Ki67 наблюдалась в группе пациенток после повторной миомэктомии, далее – у пациенток в группе после ЭМА и наименьшая – при ранее перенесенной ФУЗ-МРТ аблации (рис. 1Ж и 2В).
В группе после ЭМА экспрессия Casp3 в цитоплазме гладкомышечных клеток опухоли составила в среднем 3,5 балло, в группе после ФУЗ-МРТ аблации – 2,4 балла и в группе после миомэктомии – 4,0 балла, что было статистически значимо, p<0,01 (рис. 1З и 2В).
Исследование уровня Casp3 у пациенток до и после ЭМА, проведенные Z.P Cheng и соавт. выявили большую экспрессию данного маркера в миоматозном узле после проведения ЭМА [16].
Показатели экспрессии Ki67 как процесса пролиферации были сопоставимы с уровнем апоптоза в клетках на основании полученных данных по Casp3, что позволяет судить об относительном равновесии процессов пролиферации и апоптоза, это характерно для доброкачественной опухоли. Нами была выявлена положительная корреляция уровня иммуногистохимической экспрессии HIF-1 и Casp3. То есть, на фоне повышения факторов роста увеличивается и апоптоз, что свидетельствует о сохранности механизма регуляции роста в лейомиоцитах. Следствием этого, возможно, является низкий риск малигнизации такой опухоли (r=0,411, p<0,01) и с этой позиции относительная безопасность описанных альтернативных методов лечения миомы матки.
При проведении анализа нами была получена положительная корреляция между VEGF и Ki67, что свидетельствует о синергизме процессов неоангиогенеза и пролиферации. В исследовании В.А. Бурлева [7] производилась оценка локального и системного ангиогенеза у больных с миомой в разные фазы цикла, а также в разных топических участках лейомиомы (в центре и на периферии ткани миоматозного узла). Наши данные совпали с данными этого исследования в периферии ткани миомы, где отмечено повышение маркера пролиферации Ki67, маркеров апоптоза, а также повышенный ангиогенез.
Заключение
Таким образом, проведенная нами клинико-морфологическая оценка состояния лейомиомы после лечения методом ЭМА, ФУЗ-МРТ аблации и миомэктомии свидетельствует об определенных молекулярно-биологических механизмах развития миомы, а также экспрессии факторов роста в лейомиоцитах, в зависимости от оказанного ранее лечебного воздействия. Кроме того, удалось установить предполагаемые причины роста миоматозных узлов.
По результатам нашего исследования, повышенная экспрессия HIF-1, VEGF при доминировании процессов апоптоза над пролиферацией в группе после ЭМА свидетельствует о влиянии данной методики на активацию неоангиогенеза лейомиоцитов в условиях гипоксии, что является одним из механизмов роста миомы и возможной неэффективности ЭМА. У пациенток после ФУЗ-МРТ аблации, напротив отмечена низкая активация процессов неоангиогенеза, на фоне повышенной экспрессии IGFR-1, что свидетельствует об иных механизмах роста таких лейомиом и меньшей частоты дегенеративно-дистрофических изменений. Следует отметить, что во всех исследуемых группах нами не были выявлены нарушения регуляции в лейомиоме, на основании преобладания процессов апоптоза над пролиферацией.
С клинической точки зрения заслуживает внимания высокий процент выявления новых патологически расширенных сосудов и относительно высокой интраоперационной кровопотери в группе после ЭМА, что ведет к более трудной реабилитации таких пациенток. В группах после альтернативных методов лечения отмечаются значительные трудности при вылущивании миоматозных узлов в связи с наличием дегенеративно-дистрофических изменений, что с технической точки зрения затрудняет проведение операций у таких пациенток.



