Заболевания, ассоциированные с вирусом папилломы человека (ВПЧ), являются одной из важнейших проблем в акушерстве и гинекологии. Данный вирус вызывает целый ряд инфекционных заболеваний кожи и слизистых оболочек. В настоящее время известно уже более 200 типов папилломавирусов, причем 40 из них поражают мочеполовые органы.
В связи с резким ростом инфицированности населения ВПЧ, значительной его контагиозностью и способностью вызывать злокачественную патологию диагностика и лечение заболеваний, ассоциированных с папилломавирусной инфекцией, привлекают внимание врачей различных специальностей [1]. Согласно данным ВОЗ, папилломавирусная инфекция является самой распространенной инфекцией, передающейся половым путем, в Европе и значимой проблемой общественного здравоохранения [14].
На сегодняшний день доказано, что папилломавирусная инфекция является ведущей причиной рака шейки матки [15, 20, 18]. При инвазивном раке шейки матки в 95–100% случаев выявляется ВПЧ.
Как показали исследования последних лет, большинство женщин на протяжении жизни инфицируются ВПЧ. Так, например, более 80% женщин заражаются ВПЧ уже через 2 года после начала половой жизни, при этом даже при наличии одного полового партнера 20% женщин являются зараженными ВПЧ [10, 13]. ВПЧ обнаруживают у 99,7% женщин с гистологически подтвержденным диагнозом рака шейки матки. При этом нередко определяется инфицированность различными типами ВПЧ, в том числе у женщин с нормальной цитологией. Риск инфицированности одним штаммом ВПЧ не снижает риска инфицированности филогенетически родственным типом вируса.
Рак шейки матки является не только медицинской, но и социальной проблемой. Ежегодно в мире
регистрируется до 500 тыс. новых случаев этого заболевания и 270 тыс. смертей, вызванных цервикальным раком [19]. В Европе рак шейки матки занимает 2-е место в структуре онкологических заболеваний у женщин в возрасте от 15 до 45 лет. В России заболеваемость раком шейки матки
составляет 15,2 на 100 тыс. женского населения, ежегодный прирост заболеваний среди молодых
женщин составляет от 2 до 5%, удельный вес запущенных стадий увеличился на 35 – 45%, смертность составляет от 6000 до 8000 лиц ежегодно [13, 14]. На сегодняшний день рак шейки матки является одной из основных причин смерти от злокачественных опухолей у женщин в возрасте 35 – 40 лет.
Папилломавирусы являются антропонозными возбудителями, т. е. передача их возможна только
от человека к человеку. Основным путем заражения ВПЧ является половой (включая оральногенитальные контакты и анальный секс). Есть вероятность сохранения в течение определенного времени вирусов в отшелушивающихся клетках кожи, поэтому для некоторых заболеваний, вызываемых вирусом (бородавки), вероятен контактнобытовой путь заражения при условии микроповреждений кожи.
Доказана возможность передачи папилломавирусной инфекции от матери плоду с поражением гортани (ларингеальный папилломатоз) и появлением аногенитальных бородавок у новорожденного, а также способность поражать клетки трофобласта, что может являться причиной прерывания беременности [15, 20].
Инкубационный период при заражении ВПЧ составляет от 3 мес до нескольких лет.
Факторами риска инфицирования ВПЧ являются :
• раннее начало половой жизни,
• наличие более 3 половых партнеров,
• наличие одного полового партнера, у которого множество половых партнеров,
• курение,
• наличие других инфекций, передающихся половым путем (ИППП),
• нарушение иммунитета,
• факторы окружающей среды, условия жизни и работы.
По онкогенной опасности для человека условно выделяют три группы типов папилломавирусов
(см. таблицу):
• неонкогенные папилломавирусы ‒ никогда не вызывают озлокачествление вызванного ими
процесса;
• онкогенные папилломавирусы низкого риска при определенных условиях (достаточно редко) могут вызвать озлокачествление вызванного процесса;
• онкогенные папилломавирусы высокого онкогенного риска ‒ под влиянием различных факторов вызывают озлокачествление вызванного ими процесса и являются доказанным этиологическим фактором рака шейки матки.
Таблица. Папилломавирусы разных типов и вызываемые ими заболевания.
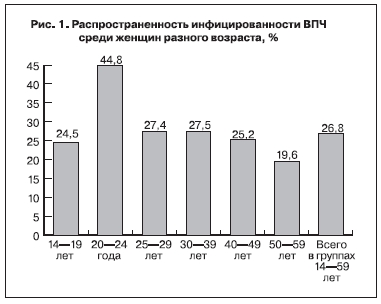
Частое инфицирование характерно для молодых женщин и особенно для подростков (рис. 1, см. на вклейке) [11].
Течение папилломавирусной инфекции во многом зависит от состояния иммунной системы. В 70–80% случаев оно может быть транзиторным, и тогда наблюдается спонтанное очищение пораженной ткани от ВПЧ. Столь благоприятный исход возможен у молодых женщин с нормальным состоянием иммунной системы.
Латентное течение ВПЧ-инфекции характеризуется отсутствием клинических и морфологических изменений при обнаружении ДНК вируса. В этом случае требуется наблюдение и постоянный контроль состояния эпителия шейки матки, влагалища и вульвы [11, 19].
В 20–30% случаев при ВПЧ-инфекции наблюдается прогрессирование заболевания. После элиминации вируса у части женщин сохраняются субклинические проявления инфекции, которые могут переходить в клиническую фазу у женщин с нарушением иммунитета [12]. ВПЧ довольно долго персистирует в многослойном плоском эпителии, что способствует рецидивированию заболевания.
Следует отметить и то, что папилломавирусная инфекция часто сочетается с другими ИППП, что
оказывает существенное влияние на клинические проявления, особенности течения и прогноз и, что
немаловажно, устойчивость к проводимой терапии.
По варианту течения и глубине поражения ВПЧ-ассоциированные заболевания нижнего отдела гениталий делятся на следующие формы [3, 11, 12]:
1. Клинические (видимые невооруженным глазом):
– экзофитные кондиломы (остроконечные типичные, папиллярные, папуловидные);
– симптоматические цервикальные интраэпителиальные неоплазии.
2. Субклинические (невидимые невооруженным глазом и бессимптомные, выявляемые только при
кольпоскопии и/или цитологическом либо гистологическом исследовании):
– плоские кондиломы (типичная структура с множеством койлоцитов);
– малые формы (различные поражения многослойного плоского эпителия и метапластического эпителия с единичными койлоцитами); – кондиломатозный цервицит/вагинит.
3. Латентные (отсутствие клинических, морфологических или гистологических изменений при
обнаружении ДНК ВПЧ).
4. Цервикальная интраэпителиальная неоплазия (CIN) или плоскоклеточные интраэпителиальные
поражения (SIL) и рак шейки матки:
‒ CIN I – слабая дисплазия с койлоцитозом, дискератозом или без них;
‒ CIN II – умеренная дисплазия с койлоцитозом, дискератозом или без них;
‒ CIN III – тяжелая дисплазия или карцинома in situ с койлоцитозом, дискератозом или без них;
‒ микроинвазивная плоскоклеточная и железистая карцинома.
Субклинические формы – плоские кондиломы, вирусные цервициты и вагиниты – являются причиной частых обращений больных к врачам с жалобами на дискомфорт, обусловленный зудом, жжением, обильными выделениями, рецидивирующим бактериальным вагинозом и кандидозом. В большинстве случаев у таких пациенток возникают обострения клинических симптомов перед каждой менструацией. Клинические формы течения ВПЧ-инфекции – экзофитные кондиломы могут быть незначительны по размерам и площади поражения, но вызывать нестерпимый зуд у пациенток, и наоборот, достаточно большие образования бывают врачебной находкой во время профилактического осмотра. Длительная персистенция ВПЧ в ткани органов нижнего отдела генитального тракта способна провоцировать развитие предраковых и раковых процессов.
Целый ряд онкологических заболеваний связан с высокоонкогенными типами ВПЧ, в первую очередь с 16 и 18 [16, 19], в их числе рак шейки матки, рак прямой кишки, рак влагалища и вульвы, рак полового члена, рак гортани, рак ротовой полости.
Для диагностипи ВПЧ-ассоциированных заболеваний применяются следующие методы исследования:
• клинические;
• цитологические (Pap-test);
• расширенная кольпоскопия;
• подтверждение наличия ДНК ВПЧ в цервикальном эпителии (ПЦР);
• определение вирусной нагрузки метод Hybride Capture (ВПЧ-Digene-тест), позволяющее выявить
число копий ДНК онкогенных вирусов;
• ПЦР в режиме реального времени;
• жидкостная цитология;
• морфологическое исследование;
• определение онкомаркеров – онкобелков p16, Кi67;
• сканирование шейки матки в режиме реального времени (TruScreen) и др.
TruScreen представляет собой портативный диагностический сканер, позволяющий идентифицировать наличие предраковых процессов тканей шейки матки в режиме реального времени при обычном гинекологическом обследовании с помощью специального зонда, наконечник которого содержит электроды для измерения сопротивления ткани и источники света для измерения оптических свойств ткани.
Высокочувствительной методикой определения ВПЧ является Digene-тест. Данная методика позволяет выявить папилломавирус, определить его тип и принадлежность к высоко- или низкоонкогенной группе и зафиксировать его клинически значимую концентрацию в тканях. Это служит важным прогностическим признаком.
Digene-тест является общепринятым во всем мире, поскольку, опираясь на его результаты, можно разработать единые критерии тактики лечения. Кроме того, в силу высокой клинической чувствительности и специфичности данный метод рекомендуется для проведения скрининга.
На сегодняшний день существуют программы скрининга рака шейки матки, включающие в себя цитологическое исследование по Папаниколау (ПАП-тест) и при его аномальных результатах – кольпоскопию и гистологическое исследование. Проведение скрининга рекомендовано женщинам от 25 до 50 лет с интервалом 3 года и каждые 5 лет у женщин в возрасте от 50 до 65 лет.
Широкое внедрение скрининга позволило своевременно выявлять доброкачественные поражения и предопухолевые состояния шейки матки, определить этиологические факторы и проводить адекватное лечение. Например, в Финляндии благодаря внедрению скрининга на общенациональном
уровне удалось снизить заболеваемость и смертность вследствие рака шейки матки на 75–85%.
В настоящее время единого стандарта лечения пациентов с ВПЧ-ассоциированной инфекцией не существует. Основное лечение ВПЧ-ассоциированных заболеваний представлено деструктивными методиками, такими как:
• применение цитотоксических препаратов (подофиллин, подофиллотоксин, 5-фторурацил и др.);
• химическая деструкция (трихлоруксусная кислота, солкодерм и др.);
• физическая деструкция (крио-, электродеструкция, CO2-лазерная вапоризация, радиоволновая хирургия, аргоноплазменная абляция, фотодинамическая терапия).
Деструктивные методики при всей своей эффективности являются достаточно травматичными, а иногда вызывают нарушение анатомо-функциональной целостности шейки матки. Кроме того, могут сопровождаться рецидивами и резкой манифестацией процесса [11].
На современном этапе продолжаются поиски эффективных, недорогих, малотравматичных и безопасных методов лечения.
При ВПЧ-ассоциированных заболеваниях, как и в случае с другими хроническими заболеваниями с длительным персистированием вирусов, закономерно развиваются иммунодефицитные состояния, которые рассматриваются как вторичные иммунодефициты, обусловленные недостаточностью разных звеньев иммунной системы [5, 8].
Исследования, посвященные изучению молекулярных механизмов инфицирования, персистенции и размножения ВПЧ в эпителиальных клетках человека, обосновали применение дополнительной иммунотерапии при инфицировании половых органов ВПЧ с клинической манифестацией [5, 13, 21, 22].
Современный взгляд на лечение ВПЧ-ассоциированных заболеваний подтверждает необходимость применения противовирусной и иммуномодулирующей терапии, так как состояние иммунной системы во многом определяет характер течения ВПЧ-инфекции.
Иммуномодулирующие препараты подавляют репликацию вируса, усиливают защитные механизмы иммунной системы, особенно у пациентов с ее нарушениями.
Одним из препаратов, хорошо зарекомендовавшим себя в лечении не только пациентов с ВПЧ-ассоциированными заболеваниями, но и с другими вирусными инфекциями, является синтетический аналог инозина – Inosine Pranobex (изопринозин).
Inosine Pranobex (изопринозин) оказывает двойное действие – иммуномодулирующее и противовирусное, состоит из двух компонентов: активного компонента – инозина, метаболита пурина (1,9-дигидро-9-в-D-рибофуранозило6Н-пурин-6-OH) и вспомогательного компонента, повышающего доступность инозина для лимфоцитов (соли 4-ацетамидобензойной кислоты с N,N-диметиламино-2-пропанолом).
Препарат подавляет репликацию ДНК и РНК ВПЧ посредством связывания с рибосомой клетки и изменения ее стереохимического строения и способствует восстановлению клеточного звена иммунитета.
Inosine Pranobex (изопринозин) включен в европейские стандарты лечения больных с папилломавирусной инфекцией и считается иммуномодулятором универсального стимулирующего типа с преобладанием тимомиметических эффектов, активирует пролиферацию Т-лимфоцитов, Т-хелперов, естественных клеток (NK)-киллеров, уравновешивает баланс клеточного и гуморального звена в иммунной системе [4, 13, 18]. Стимулируя биохимические процессы в макрофагах, усиливает хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфно-ядерных клеток. Кроме того, параллельно повышает продукцию цитокинов (интерферонов и интерлейкинов) и усиливает синтез антител.
Фармакокинетика препарата хорошо изучена. Максимальная концентрация достигается через 1 ч после приема 1,5 г препарата. Первый период полувыведения составляет 50 мин и связан с образованием мочевой кислоты. Второй период полувыведения – 3–5 ч, при этом метаболиты выводятся почками. Во время приема Inosine Pranobex (изопринозин) не рекомендуется применять иммунодепрессанты и лекарственные средства с нефротоксическим действием.
Рекомендуемая доза препарата взрослым составляет 50 мг/кг в сутки, разделенные на 3–4 приема. При папилломавирусной инфекции взрослым препарат назначают по 2 таблетки 3 раза в день в 3–4 приема в течение 14‒28 дней в виде монотерапии. При рецидивирующих остроконечных кондиломах взрослым препарат назначают по 2 таблетки 3 раза в 3–4 приема в день либо в качестве монотерапии или в комбинации с хирургическим лечением в течение 14–28 дней, далее с трехкратным повторением
указанного курса с интервалами 1 мес.
При дисплазии шейки матки, ассоциированной с ВПЧ, назначают по 2 таблетки 3 раза в день в течение 10 дней, далее проводят 2–3 аналогичных курса с интервалом 10–14 дней [4].
Проанализировав данные по применению иммуномодуляторов, J. Rhodes [21] считает, что противовирусный эффект Inosine Pranobex связан с его способностью усиливать продукцию IFN-α.
В медицинской практике изопринозин начал применяться с 1973 г. в США, а с 1978 г.- в странах Евросоюза. Под различными торговыми названиями препарат зарегистрирован в 73 странах в качестве лекарственного средства для лечения ряда вирусных (в том числе папилломавирусных) и иммунодефицитных заболеваний. Более чем за 35-летний период медицинского применения изопринозина было проведено около 60 клинических исследований по эффективности и переносимости препарата.
Исследования, проведенные в ряде ведущих научных учреждений России и других стран, показали, что Inosine Pranobex (изопринозин) достоверно повышает эффективность лечения ВПЧ-ассоциированных заболеваний, в том числе CIN и даже рака шейки матки, уменьшая выраженность клинических проявлений, ускоряя реконвалесценцию, повышая резистентность организма [2, 3, 9–11].
Ряд авторов сообщают об эффективности комбинированного лечения ВПЧ-ассоциированных заболеваний. На первом этапе лечения больные по поводу CIN и рака шейки матки по показаниям подвергались деструктивным методам лечения (электрокоагуляция, криодеструкция, лазеровапоризация, электроконизация). На втором этапе проводилось противовирусное лечение, так как персистенция вируса является ключевым фактором для возникновения рецидива заболевания
[6, 12]. Было отмечено, что применение Inosine Pranobex (изопринозин) до операции (1000 мг 3 раза в сутки в течение 10 дней) сопровождается значительным снижением активности ВПЧ 16-го и 18-го типов, определяемых при ПЦР-диагностике. Уже после первого курса лечения тест на вирус был отрицательным у 77,8% больных [9–11]. В 2008 г. была разработана и внедрена программа «АСТРА» ‒ общероссийская многоцентровая программа мониторинга, обобщения и формирования статистической отчетности об особенностях и результатах применения изопринозина при лечении заболеваний, ассоциированных с ВПЧ, в условиях обычной медицинской практики. Программа «АСТРА» разработана и внедрена на основе принципов доказательной медицины. В программе принимали участие 250 практикующих гинекологов и дерматовенерологов из 26 городов России. В исследование был включен 6191 пациент (5896 женщин и 295 мужчин).
Inosine Pranobex (изопринозин) применялся при остроконечных кондиломах, CIN, субклиинических формах ВПЧ в комбинированном режиме.
Результаты исследования показали, что лечение остроконечных кондилом изопринозином оказалось эффективным у 91% пациенток, комбинированное лечение CIN I – у 90% пациенток, комбинированное лечение CIN II – в 82% случаев, при лечении субклинической формы ВПЧ эффективность достигала 91% [11,12].
Эффективность применения изопринозина в лечении ВПЧ-ассоциированных заболеваний была изучена в поликлиническом отделении ФГУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова (рис. 2, см. на вклейке) [11,12].
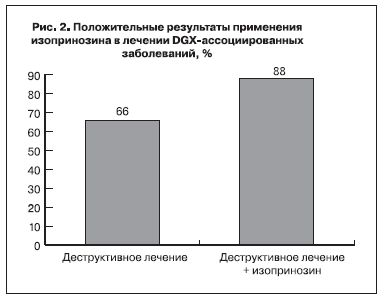
Результаты исследования свидетельствуют о достоверном уменьшении (в 3 раза) частоты рецидива заболеваний, ассоциированных с ВПЧ, при применении изопринозина.
Клинически выраженный эффект улучшения самочувствия пациенток с прекращением патологических выделений (бели) обнаружен после монотерапии с Inosine Pranobex в 72,4 % случаев, а элиминация вирионов ВПЧ- инфекции – в 66% наблюдений, что было подтверждено результатами Digene-теста [12].
Клинические проявления хронического вульвовагинита и цервицита, ассоциированного с ВПЧ, сопровождаются изменениями системного и локального иммунитета, что может проявляться снижением выработки фактора некроза опухоли и повышением продукции интерлейкина-10 клетками эпителия, снижением интерферона-α и повышением сывороточного интерферона в периферической крови наряду с изменениями клеточного иммунитета. Данные, полученные при применении Inosine Pranobex при вульводинии, обусловленной хроническим инфекционно-воспалительным процессом, свидетельствуют о том, что эффективность комбинированного лечения (этиотропная антибактериальная терапия и Inosine Pranobex) была достоверно выше и составила 87,5% против 50% при антибактериальной монотерапии [11, 12].
Рассматривая влияние препарата на ВПЧ, необходимо отметить, что Inosine Pranobex (изопринозин) предотвращает рецидив ВПЧ-ассоциированных заболеваний.
Использование противовирусных препаратов снижает вероятность персистенции ВПЧ и воз-никновения рецидивов заболевания. Адекватная иммунотерапия способствует более полной элиминации возбудителей и полноценной эпителизации шейки матки, что снижает частоту рецидивов и повышает эффективность терапии ВПЧ-ассоциированных заболеваний.
Комбинированное использование Inosine Pranobex и деструктивных методов лечения способствует удлинению межрецидивного периода, прекращению вирусовыделения, в том числе при выявлении нескольких серотипов, включая высокоонкогенные 16-й и 18-й типы, со слизистых оболочек мочеполовых органов и уменьшению количества местных деструктивных воздействий.
Таким образом, комплексную терапию ВПЧ-ассоциированных заболеваний, включающую деструктивное лечение поражений и применение препаратов с противовирусным и иммуномодулирующим действием, на современном этапе можно рассматривать как наиболее эффективную.



