Во второй половине XX века в связи с развитием медицины и совершенствованием перинатальной службы частота потери плода снизилась в 10 раз. Произошло значительное снижение уровня интранатальной и неонатальной смертности, однако уровень антенатальной гибели плода (АГП) остается высоким и составляет почти 50% в структуре перинатальных потерь [1–5]. По данным Росстата (2015 г.) в структуре младенческой смертности смертность новорожденных, в том числе и мертворождений составляет до 60%, в структуре детской смертности – до 50%, в структуре смертности детей до 17 лет – 38%. Из всех возрастных групп населения вклад в увеличение продолжительности жизни максимален за счет снижения младенческой смертности [2]. Соответственно перинатальная и антенатальная охрана плода обеспечивает программирование будущего здоровья.
К сожалению, до настоящего времени проблема АГП является полиэтиологичной и неоднозначной проблемой, в том числе в плане выработки единых подходов к профилактике и акушерской тактике. Так, ежегодно в мире насчитывается 4 млн случаев смерти новорожденных, и кроме этого, мертворождение отмечается в 1–3% всех родов, достигая 3 млн. В 2013 г. мертворождаемость в Дании составила 3,9 на 1000 всех родов, в Финляндии – 2,62, в Германии – 3,73, в Швейцарии – 4,84, в странах Европейского Союза – 4,05, в Европейском регионе – 4,05 [1, 4, 5].
В России уровень антенатальных потерь до 2012 года составлял 4,62–4,49 на 1000 родившихся живыми и мертвыми (р.ж.м) с 28 нед. гестации [2, 4].
Однако с 2012 года после перехода в Российской Федерации (РФ) на учет перинатальных потерь с 22 нед. беременности, отмечено возрастание числа мертворождений до 6,34 и 5,8 на 1000 р.ж.м. в 2012 и 2013 гг. соответственно, в том числе и в большей степени в «пограничные» сроки (22–28 недель). При этом в 2014 г. в РФ снизились мертворождаемость и младенческая смертность – в 40 регионах, а повышение мертворождаемости при снижении младенческой смертности отмечено в 22 регионах [2].
Этиология АГП многообразна, нередко этиологические факторы не имеют клинических проявлений до беременности. Плацентарная недостаточность (ПН) достигает 60–65,6% в генезе антенатальных потерь. Несмотря на использование современных методов в диагностике причин смерти плода, выявление основной причины остается трудной задачей в 60% мертворождений [4–8]. Известно, что АГП в анамнезе является фактором риска, как повторных неблагоприятных исходов последующей беременности, так и высокой неонатальной и младенческой заболеваемости и смертности [5, 7–11].
В связи с вышесказанным, целью нашего исследования стало выявление факторов риска повторных репродуктивных потерь у женщин с АГП в анамнезе на этапе подготовки к последующей гестации и разработка дифференцированного подхода к тактике ведения беременности на основании комплексного клинического, эхографического и лабораторного обследования состояния фетоплацентарной системы для снижения перинатальной заболеваемости и смертности.
Материал и методы исследования
В исследование были включены 340 женщин, которые дали письменное информированное согласие на участие. Исследование проводилось в 2 этапа: I этап (прегравидарный) – проспективное комплексное лабораторно-инструментальное обследование на этапе подготовки к беременности 150 женщин из 2 групп. Проспективную группу составили 90 женщин, которые перенесли 94 эпизода АГП в сроки 22–41 нед. при предыдущей беременности. Критериями исключения стали: многоплодная беременность, наркотическая и алкогольная зависимость, тяжелые формы психических заболеваний. Контрольную группу составили 60 женщин с неотягощенным соматическим и акушерско-гинекологическим анамнезом, планировавших беременность.
II этап (гестационный) – проспективный анализ течения беременности, родов и перинатальных исходов у 190 женщин из 3 групп. Основная группа – 70 женщин проспективной группы, у которых наступила беременность за время исследования, проходили комплексное лабораторно-инструментальное обследование и тщательное наблюдение во время гестации. Группа сравнения – 60 беременных с АГП в анамнезе, которые проходили стандартное акушерское наблюдение и обследование в женской консультации. Контрольная группа – 60 беременных с физиологическим течением одноплодной беременности, обследованных на I этапе.
На I (прегравидарном) этапе женщины проспективной группы проходили комплексное лабораторно-инструментальное обследование, консультации врача-гематолога и врача-генетика. Исследование инфекционного статуса включало: микроскопическое исследование влагалищных мазков, бактериологический посев на флору содержимого цервикального канала, диагностику содержимого цервикального канала на инфекции, передающиеся половым путем методом полимеразной цепной реакции, серологическое исследование TORCH-инфекций. Гемостазиологическое исследование включало: плазменное звено гемостаза, фибриноген, антитромбин III, тромбоэластограмму (ТЭГ), агрегационную активность тромбоцитов с АДФ10, молекулярные маркеры тромбофилии. Проводилось обследование на генетические полиморфизмы наследственной тромбофилии. Осуществляли диагностику антифосфолипидных антител (АФА) методом иммуноферментного анализа (ИФА). Изучали тип центральной материнской гемодинамики (ЦМГ) с определением сердечного индекса (СИ), ударного индекса (УИ), общего периферического сосудистого сопротивления (ОПСС). Проводили ультразвуковое исследование (УЗИ) органов малого таза с допплерометрией кровотока в маточных артериях (МА).
Прегравидарная медикаментозная подготовка проводилась в течение не менее 3 месяцев до наступления последующей беременности всем женщинам проспективной группы, включала комплекс препаратов: препарат витаминов группы В, полиненасыщенные жирные кислоты, натуральный микронизированный прогестерон во II фазе менструального цикла. Терапию низкомолекулярными гепаринами (НМГ) назначали в следующих ситуациях: гиперкоагуляция по ТЭГ, избыток маркеров молекулярной тромбофилии (Д-димер, растворимые комплексы мономеров фибрина (РКМФ)), циркуляция материнских АФА, а также в протоколе ЭКО. При гиперагрегации тромбоцитов использовали ангиагреганты. Также вазоактивную ангиагрегантную терапию назначали при повышении резистентности кровотока в маточных артериях. Лечение урогенитальных инфекций проводили согласно современным принципам терапии.
На II этапе беременные основной группы проходили необходимое обследование в соответствии с приказом Минздрава России №572 от 12.11.2012 г. УЗИ проводили по схеме: в 6–10 нед. – оценка анатомических структур эмбриона и внезародышевых структур; в 11–13 и 16–18 нед. – ультразвуковой скрининг I и II триместров; в 20–22 нед. – ультразвуковой скрининг для исключения аномалий и пороков развития плода; в III триместре – в 28–30 нед., далее – 1 раз в 2–3 нед. при отсутствии осложнений; при развитии гестационных осложнений – по необходимости. При УЗИ в II и III триместрах проводили фетометрию, плацентографию, оценку качества и количества околоплодных вод, допплерометрическое исследование кровотока в МА, артерии пуповины (АП), аорте плода (Ао), средней мозговой артерии плода (СМА) по общепринятым методикам. Также дополнительно в основной группе проводили УЗИ за 5–7 дней до индивидуального критического срока по гибели плода в предыдущей беременности. Кардиотокографию (КТГ) проводили с 28–30 нед. гестации амбулаторно – 1 раз в неделю, при стационарном лечении – 1–2 раза в день. С целью ранней диагностики ПН в основной группе проводили ИФА-диагностику уровня VEGF-R1 в следующие сроки гестации: 16–20 нед., 21–28 нед., 29–33 нед., 32–36 нед., 37 нед. и более. Антиангиогенный фактор роста sVEGFR-1 является маркером ишемии плацентарной ткани, которая лежит в основе ПН и других осложнений беременности [12–15].
Женщины контрольной группы на прегравидарном этапе и во время гестации проходили обследование, аналогичное в проспективной и основной группах. УЗИ в контрольной группе проводились в соответствии с требованиями приказа Минздрава России № 572 от 12.11.2012 г. КТГ проводили с 28–30 нед. гестации 1 раз в 2 недели, с 34 недели – 2 раза в неделю. Беременные группы сравнения проходили стандартное акушерское наблюдение и обследование в женской консультации.
Всем беременным основной группы проводилась медикаментозная профилактика ПН с ранних сроков гестации.
Статистический анализ данных проводился на персональном компьютере с процессором IntelCore2
Duo CPU T6600 2.20 GHz в среде Windows 7 Home с использованием пакет программы GraphPad InStat Version 3.10, статистических функций программы Microsoft Office Excel 2007, программы DeFinetti на сайте Института генетики человека (Мюнхен, Германия; http://ihg2.helmholtz-muenchen.de/cgi-bin/hw/hwa1.pl). Статистически значимыми считались отличия при р<0,05 (95% уровень значимости).
У женщин проспективной группы АГП в анамнезе произошла в 22–28 нед. – в 22,2%, в 29–36 нед. – в 42,2%, в 37–41 нед. – в 35,6%. Результаты аутопсии мертворожденных и морфологического исследования плаценты показали высокую частоту задержки роста плода (48,4%), структурных фетальных аномалий (19,4%), патологии пуповины (28%) при поздних репродуктивных потерях, морфологических признаков хронической ПН (92%), низкий уровень компенсаторно-приспособительных реакций в плаценте (9,7%). С ростом гестационного срока гибели плода частота выявления воспалительных изменений последа достоверно уменьшалась с 67% во II триместре до 27% в III триместре, а частота гипоплазии плаценты увеличивалась с 22 по 37 нед. гестации. У женщин группы сравнения АГП в анамнезе произошла в 20–28 нед. – в 16,7%, в 29–36 нед. – в 50%, в 37–41 нед. – в 33,3%. Достоверно оценить результаты аутопсии мертворожденных и морфологического исследования плаценты было невозможно из-за отсутствия документов в части наблюдений. Средний возраст женщин проспективной группы составил 27,7±4,8 года, группы сравнения – 28,4±4,7 года, контрольной группы – 27,7±4,7 года, при этом 86% женщин исследуемых групп находились в возрастной категории от 20 до 34 лет.
Результаты исследования и их обсуждение
На I этапе в результате комплексного прегравидарного обследования у женщин проспективной группы (n=45) выявлены факторы, увеличивающие риск повторных репродуктивных потерь в последующей беременности: инфекционные, гемодинамические, тромбофилические, структурные нарушения миометрия. Каждое из выявленных нарушений могло стать непосредственной или опосредованной причиной АГП в предыдущей беременности.
В проспективной группе инфекция половых путей диагностирована в 64,4%, что в 16,3 раза чаще, чем в контрольной группе (OR=16,3, CI=4,27–62,3). Только в проспективной группе в 42,2% была выявлена генитальная микст-инфекция (р=0,019). В 46,6% выявлены нарушения микроценоза влагалища, сопровождающиеся клинико-лабораторными признаками воспаления нижних отделов половой системы: в 26,6% – избыточный рост условно-патогенных микоплазм M. hominis/Ureaplasma spp., в 20% – неспецифической вагинальной микрофлоры (факультативно-анаэробные грамположительные кокки и энтеробактерии). Только в проспективной группе были выявлены бактериальный вагиноз, ассоциированный с Gardnerella vaginalis – в 13,3%, вирусные генитальные инфекции, сочетающиеся с клиникой экзо/эндоцервицита – в 11%, хламидийная инфекция – в 6,7%; вульвовагинальный кандидоз – в 13,3%.
Достоверно чаще в проспективной группе выявлялись следующие инфекции TORCH-комплекса (р=0,0225): повышенные титры антител IgG к вирусам Cytomegalovirus – в 7,8 раза, к Rubella – в 6 раз, также сочетание 3 или 4 инфекций TORCH-комплекса – в 8,97 раз. В контрольной группе, наоборот, степень инфицированности женщин была достоверно меньше: в 13,3% – отсутствие иммунологических признаков перенесенной инфекции, в 13,3% – выявлены антитела только к 1 виду возбудителя. Указанные результаты на прегравидарном этапе позволили исключить персистенцию возбудителей и провести подготовку к последующей гестации для снижения риска повторных репродуктивных потерь: вакцинацию, иммунокоррекцию, иммуноглобулинотерапию.
При проведении прегравидарного комплексного эхографического исследования в контрольной группе патологические изменения отсутствовали; в проспективной группе у 20% женщин выявлены структурные и гемодинамические нарушения. В 9% наблюдений определена структурная патология матки: неполная перегородка в полости матки и интерстициальная миома – что является фактором риска неполноценной плацентации при гестации. В 9% диагностировано повышение сосудистой резистентности в одной МА, значение которой в среднем составило 4,14±0,32, что в 1,67 раз превышало среднее значение в контрольной группе (2,49±0,14) и в 1,65 раз – среднее значение в проспективной группе без нарушения гемодинамики (2,51±0,21). Данные изменения гемодинамики в МА являются фактором риска гестационных нарушений глубокой плацентации на фоне распространенного спазма спиральных артерий, и как следствие, первичной ПН. В 11% наблюдений в проспективной группе выявлен гипокинетический тип ЦМГ (УИ<24,7 мл/м2, СИ<2,4 л/мин/м2) с повышенным ОПСС (ОПСС>1500 дин·с·см-5), при этом в 6,7% – в сочетании с повышенной резистентностью в МА. При ретроспективном анализе беременности, завершившейся АГП, во всех наблюдениях гипокинетический тип ЦМГ с повышенным ОПСС сочетался с развитием нефропатии беременных, а повышенная резистентность в МА – с гемодинамическими нарушениями в системе мать-плацента-плод. Установлено, что гипокинетический тип ЦМГ с повышенным ОПСС является фактором риска развития ПН в результате сниженного сердечного выброса и недостаточного снижения периферической резистентности в МА во время инвазии трофобласта [5, 6, 15]. Таким образом, комплексное ультразвуковое и эхографическое обследование у 20% женщин проспективной группы позволило выявить дополнительные факторы риска развития ПН при последующей беременности. Эти данные доказывают необходимость проведения на прегравидарном этапе не только рутинного УЗИ органов малого таза, но и исследования внутриматочной и системной гемодинамики.
На I этапе проведено комплексное исследование системы гемостаза. Как в проспективной группе, так и в контрольной группе не были выявлены следующие полиморфизмы: гомозиготный полиморфизм гена F5 (1691 G>A), гомозиготный и гетерозиготный полиморфизм гена FII (20210 G>A), гомозиготный полиморфизм гена фибриногена FGB (-455 G>A). Сравнительный анализ частот генотипов и аллелей генов FV, FII, FGB, GpIIIa, PAI-1, MTHFR не выявил статистически значимых различий между проспективной и контрольной группами (p>0,05; df=1 и p>0,05; df=2). Однако при сравнении исследуемых групп методом «суммы баллов генотипов» [15] средняя сумма баллов по всем полиморфизмам генов системы свертывания крови для проспективной группы составила 2,53, что в 1,35 раза выше, чем в контрольной группе (1,73). Эти данные свидетельствуют, что женщины с АГП в анамнезе имеют более высокий коагуляционный потенциал, чем женщины контрольной группы. Только в проспективной группе выявлена циркуляция материнских АФА в 18% наблюдениях (р=0,019), из них: в 37,5% выявлен антифосфолипидный синдром – сочетание циркуляции антикардиолипиновых антител, волчаночного антикоагулянта и антител к β2-гликопротеину-1 с синдромом потери плода; в 37,5% – циркуляция АФА к фосфатидилсерину; в 25% – циркуляция АТ к кофакторам фосфолипидов – аннексину V, протромбину. При циркуляции АФА во всех наблюдениях АГП выявлена задержка внутриутробного развития мертворожденных, при морфологическом исследовании плаценты – гипоплазия и нарушения микроциркуляции. При этом АФА являются причиной нарушения процессов имплантации и плацентации, микроциркуляции и сосудистого тромбоза.
При исследовании расширенной гемостазиограммы в проспективной группе в 46,7% выявлены нарушения различных звеньев системы свертывания крови: гиперагрегация тромбоцитов с АДФ10 – в 16% (р=0,0374), гиперкоагуляция по ТЭГ – в 18% (р=0,0186), повышение маркеров внутрисосудистого свертывания крови – в 31%: раннего (РКМФ) – в 13,3%, позднего (Д-димер) – в 11%, (р=0,0005), в 6,7% – сочетанное повышение РКМФ и Д-димера. Уровень антитромбина III и гомоцистеина находились в пределах референсных значений в обеих группах. Показатели гемостаза в группе контроля находились в пределах нормы. В основной группе терапия НМГ была назначена 40% женщин: в 35,5% – при выявлении гиперкоагуляции по ТЭГ, маркеров внутрисосудистого свертывания крови, циркуляции АФА, в 2,2% – персистенция герпесвирусной инфекции, в 2,2% – в протоколе ЭКО при нормальных показателях гемостаза. В 17,8% назначена антиагрегантная терапия: в 6,7% – на фоне изолированной гиперагрегации тромбоцитов, в 11,1% – при сочетанных нарушениях агрегации тромбоцитов и внутриматочной гемодинамики. Выявленная патология различных звеньев системы гемостаза подтверждает современные рекомендации о проведении комплексного гемостазиологического обследования женщин с репродуктивными потерями при подготовке к последующей гестации для выявления предрасположенности к тромботическим осложнениям как возможной причине АГП [14–18]. При этом результаты генетического исследования необходимо оценивать в комплексе с данными расширенной гемостазиограммы, результатами морфологического исследования плаценты, тромботическим и акушерским анамнезом.
Таким образом, проведенное в проспективной группе комплексное эхографическое исследование, обследование инфекционного и гемостазиологического статуса выявило существующие факторы риска повторных репродуктивных потерь, которые не имели клинического проявления. Это позволило провести комплекс лечебных и профилактических мероприятий при подготовке к гестации. После прегравидарной подготовки у 70 женщин проспективной группы наступила повторная беременность не менее чем через 6 месяцев после АГП. Эти женщины составили основную группу на II этапе исследования.
Во время гестации у 17% беременных основной группы выявлены повторные нарушения микроценоза влагалища, успешно пролеченные до беременности. Дисбиоз проявлялся избыточным ростом неспецифической микрофлоры, преимущественно выявлялся во II триместре и сопровождался клиникой угрожающего прерывания беременности. У 2 (2,9%) беременных основной группы наблюдалось рецидивирующее течение генитального герпеса, несмотря на курсовое иммунокорригирующее лечение, что сопровождалось клиникой угрожающего прерывания беременности и ПН. В группе сравнения исследования микроциноза влагалища в полном объеме были проведены лишь в 50% наблюдений. У 47% обследованных беременных выявлен избыточный рост неспецифической микрофлоры и грибов рода Candida. В контрольной группе во время беременности нарушения микроценоза влагалища отсутствовали. Эти результаты показали, что нарушения микроценоза влагалища у женщин с АГП в анамнезе имеют тенденцию к рецидивирующему течению во время гестации, что требует своевременной диагностики и лечения.
В основной группе с этапа прегравидарной подготовки терапию НМГ получали 42,8% женщин. В сроки 10–18 нед. у 45% беременных с референсными значениями показателей гемостазиограммы до гестации первично выявлена патологическая активация внутрисосудистого свертывания крови: чрезмерное повышение Д-димера – в 30%, из них совместно с РКМФ – в 15%, гиперагрегация тромбоцитов с АДФ10 – в 15%, гиперкоагуляция по ТЭГ – в 10%. В течение гестации у 12,5% беременных в сроки 28–29 нед. диагностировались повторные нарушения в системе гемостаза на фоне проводимой патогенетической терапии. За время беременности количество женщин, получающих терапию нарушений гемостаза, возросло в 1,6 раза и составило 68,6%, из них: терапию НМГ получали 48,5% беременных, терапию антиагрегантами – 8,6%, терапию НМГ и ангиагрегантами – 20%. Достоверной связи между изменениями показателей гемостаза и тромбофилиями не выявлено. У 31,4% беременных наблюдалась физиологическая активация системы гемостаза, что не потребовало назначения НМГ. Женщинам группы сравнения на этапе ведения беременности данные исследования не проводились. В контрольной группе показатели гемостаза оставались в пределах референсных значений физиологической активации при гестации. Данные результаты доказывают необходимость контроля за динамикой изменений показателей гемостаза у беременных с АГП в анамнезе.
После проведения детального УЗИ на ранних сроках у 25,7% беременных основной группы выявлены факторы риска нарушения глубокой плацентации. Из них в 8,6% – ретрохориальная гематома больших размеров, а также сохраняющиеся с прегравидарного этапа изменения: повышенная резистентность в МА – в 11,4%, гипокинетический тип ЦМГ с повышенным ОПСС – в 14,3%, сочетанные нарушения внутриматочной и системной гемодинамики – в 8,6%. В результате I пренатального скрининга у 8,6% беременных выявлен высокий риск генетической патологии, связанный со снижением РАРР-А белка, что опосредованно может свидетельствовать о нарушении функции плаценты. Риск генетической патологии был исключен. В группе сравнения при наблюдении в женской консультации пренатальный скрининг выполнен только 66,7% беременным, патологии не выявлено, исследование внутриматочной и системной гемодинамики не проводилось. Полученные в основной группе данные доказывают необходимость проведения комплексного эхографического исследования с ранних сроков беременности у данного контингента беременных. Частота ПН в основной группе составила 40%. На фоне проведения медикаментозной профилактики с ранних сроков беременности выявлялась только компенсированная ПН, в 57% проявляющаяся изолированными гемодинамическими нарушениями (ГН) I А (только односторонние) или I Б степени, в 43% – в сочетании с синдромом задержки роста плода I степени, маловодием и преждевременным созреванием плаценты. Хроническая гипоксия плода не выявлена. ГН I А степени были выявлены в 23%. Из них в 50% эти нарушения развились на фоне высокорезистентного кровотока в соответствующей МА, выявленного до беременности, и сохранялись на протяжении всей гестации. В данной ситуации отсутствовало физиологическое снижение резистентности кровотока в этой МА после 16 нед., однако на фоне вазоактивной антиагрегантной терапии отсутствовало нарастание тяжести нарушений внутриматочного кровотока. Во второй половине наблюдений односторонние ГН IА степени были впервые выявлены во II триместре и на фоне вазоактивной терапии восстановились до референсных значений к 35–36 нед. гестации. ГН IБ степени были диагностированы в 17%, преимущественно в сроки 32–34 нед. Из них в 83,3% наблюдений на фоне проводимого лечения произошла нормализация кровотока в АП, и в 16,7% – нарушения плодово-плацентарного кровообращения сохранялись до планового своевременного родоразрешения. Частота ПН в группе сравнения составила 53,3%, что в 1,33 раза выше, чем в основной группе. Только в группе сравнения была выявлена субкомпенсированная ПН в 13,3% (р=0,0405), проявляющаяся ГН II степени, синдромом задержки роста плода II степени, хронической гипоксией плода, централизацией плодового кровотока.
Дифференцированный подход к ведению беременности в основной группе позволил снизить частоту осложнений гестации по отношению к группе сравнения. Так частота угрожающего прерывания беременности снизилась в 1,63 раз – 28,6% в основной группе против 46,7% в группе сравнения. Преэклампсия выявлялась в 1,2 раза реже, и в 2 раза чаще проявлялась в легкой степени – 85,7% легких форм в основной группе против 43% в группе сравнения. В основной группе во всех наблюдениях преэклампсия развивалась у беременных с гипокинетическим типом ЦМГ и повышенным ОПСС. Благодаря проведению медикаментозной профилактики и дифференцированного лечения тяжесть преэклампсии у беременных основной группы в настоящую беременность была меньше, чем при беременности, завершившейся АГП.
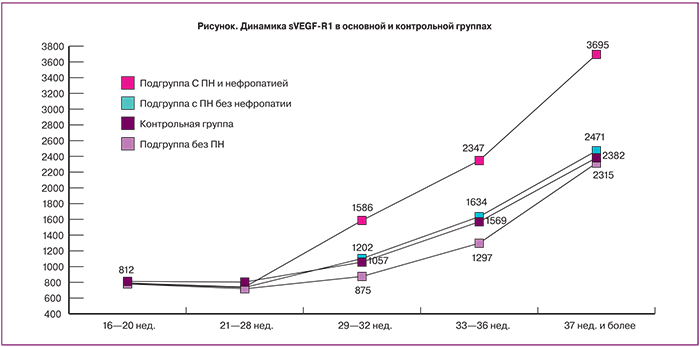
В течение наблюдаемой беременности у женщин основной группы динамика антиангиогенного фактора роста sVEGF-R1 определялась осложнениями гестации. При неосложненной беременности значение sVEGF-R1 в сроки 29–36 нед. было ниже в 1,2 раза, чем в контрольной группе, что обусловлено проведением медикаментозной профилактики ПН, в том числе при плановой госпитализации беременных в критический срок по АГП. При компенсированной ПН без преэклампсии значения sVEGF-R1 соответствовали значениям в контрольной группе во все сроки, что отражает достаточное развитие компенсаторных реакций в фетоплацентарной системе за счет своевременной диагностики и лечения ПН. При преэклампсии значения sVEGF-R1 в 1,5 раза превышали аналогичные значения при физиологической гестации с 29 нед, что свидетельствует о плацентарной ишемии при преэклампсии (рисунок). Таким образом, по уровню sVEGFR-1 можно судить о состоянии плацентарного комплекса, эффективности проводимой профилактики и лечения ПН, а также проводить раннюю диагностику преэклампсии до появления клинических признаков.
Особенностью акушерской тактики в основной группе явилась обязательная плановая госпитализация в акушерский стационар за 1 неделю до индивидуального критического срока по АГП для клинико-инструментального наблюдения за состоянием маточно-плацентарно-плодового комплекса и медикаментозной профилактики ПН.
Во всех наблюдениях в основной и контрольной группах родились живые новорожденные, в группе сравнения в 1 (3,3%) наблюдении беременность завершилась повторной АГП в результате преждевременной отслойки нормально расположенной плаценты в 30 нед. Росто-весовые показатели и оценка состояния новорожденных в основной группе была достоверно выше, чем в группе сравнения (р>0,05). В группе сравнения 17,2% новорожденных имели массу тела при рождении меньше 2500 г с индивидуальными колебаниями от 820 до 2430 г и недоношенность по массе от I до IV степени, что в 6 раз чаще, чем в основной группе (3%). У всех недоношенных новорожденных группы сравнения был диагностирован синдром дыхательных расстройств и ишемически-гипоксическое поражение центральной нервной системы, что потребовало перевод на искусственную вентиляцию легких и дальнейшее лечение в отделении реанимации. У новорожденных основной группы в 2 раза реже потребовалось проведение искусственной вентиляции легких, реанимационных мероприятий. Таким образом, перинатальные потери в группе сравнения, дыхательные расстройства у доношенных новорожденных основной группы свидетельствуют о высоком риске перинатальной заболеваемости в результате патологии плода у женщин с АГП в анамнезе.
Заключение
Таким образом, беременные с АГП в предыдущей беременности, составляют группу крайне высокого перинатального риска повторных репродуктивных потерь. Комплексное предгравидарное обследование женщин с АГП в анамнезе позволяет выявить факторы риска повторных неблагоприятных исходов последующей беременности: инфекционные, генетические, тромбофилические, гемодинамические, структурные. Это позволяет провести лечение для снижения их патологического влияния при имплантации и плацентации. Осуществление динамического лабораторно-инструментального обследования, проведение медикаментозной профилактики ПН с ранних сроков беременности, выработка индивидуальной акушерской тактики у беременных с АГП в анамнезе являются залогом улучшения перинатальных исходов и снижения перинатальной заболеваемости.



