Соматический тканевой хромосомный мозаицизм – это присутствие в соматических тканях организма двух или более популяций клеточных линий с различным хромосомным набором. Данный биологический феномен лежит в основе патогенеза многих заболеваний. Нестабильность функционирования и неравномерность распределения клеточных линий с различными хромосомными мутациями приводит к формированию широкого спектра генетической патологии [1].
Причины формирования у эмбриона клеточных линий с различными хромосомными нарушениями активно изучаются. Предполагается, что аномальное разделение клеточных линий происходит на постзиготической стадии эмбрионального развития. Нарушения в клеточном цикле клетки могут быть обусловлены как мутациями в регуляторных генах, так и эпигенетической инактивацией данных генов или эпимутациями. В исследовании А.А. Кашеваровой [2] показана роль эпимутаций генов P14ARF и RB1 и ряда других у спонтанных абортусов человека с хромосомным мозаицизмом. В основе механизма инактивации регуляторных генов лежит гипометилирование. Также установлено, что у 88% спотанных абортусов клеточный мозаицизм возникает путем коррекции первичной трисомии мейотического происхождения. Обнаружены различные типы связи между эпимутациями и мозаицизмом – эпимутация может быть первичной, то есть предшествовать формированию мозаицизма; нарушения метилирования могут появиться на фоне уже существующего мозаичного кариотипа. В этом случае эпимутация может иметь значение для коррекции хромосомного нарушения. Возможны варианты, когда эпимутация и мозаицизм независимо присутствуют в разных тканях, и невозможно однозначно определить первичность или вторичность аберрантного метилирования.
Соматический хромосомный мозаицизм играет важную роль в канцерогенезе. Хорошо изучено влияние хромосомной нестабильности на развитие различных типов опухолей [1, 3–5].
Соматический тканевой мозаицизм может проявляться не только в виде анеуплоидий по целым хромосомам, но и в виде клеточных линий с фрагментами хромосом, а также c моногенными мутациями и однородительскими изодисомиями [1, 6]. Мозаицизм также может быть причиной неравномерного роста и функционирования тканей при различных нейродегенеративных заболеваниях и синдромах: туберозном склерозе (OMIM #191100), нейрофиброматозе (OMIM #162200) [1]; cоматический мозаицизм лежит в основе гемигипертрофий и патологического ангиоматоза при синдромах Протея (OMIM #176920), Клиппера–Треноне–Вебера (OMIM %149,000), Штурге–Вебера и многих других [1] .
В литературе имеются публикации, посвященные исследованиям соматического мозаицизма в тканях головного мозга у пациентов с аутизмом. Использование у таких больных методов молекулярного анализа с определением CNVs (copy-number variations) показало увеличение числа мутаций de novo в коре головного мозга, что может быть причиной дезорганизации в работе кортикальных структур мозга [7].
Более мягкие проявления соматического тканевого мозаицизма, связанные с нарушениями инактивации Х-хромосомы, могут быть в виде неравномерности пигментации кожных покровов, так называемых «линий Блашко» [8].
В сфере репродукции человека хромосомный соматический мозацизм, являющийся распространенным общебиологическим процессом, очевидно, также играет важную роль.
Наиболее часто проявления соматического мозаицизма наблюдаются при использовании методов экстракорпорального оплодотворения (ЭКО). По данным мультицентрового обзора 36 исследований у 815 преимплантационных эмбрионов человека только 177 (22%) были диплоидными, а 73% оказались мозаичными [9]. В исследовании E. Vanneste с соавт. [10] методами молекулярно-генетического анализа показано, что на ранних стадиях эмбриогенеза у большинства эмбрионов имеются мозаичные нарушения не только в виде анеуплоидий, но и виде микроделеций, микродупликаций, потери гетерозиготности по типу однородительской изодисомии.
Роль хромосомного дисбаланса плаценты в развитии акушерских осложнений также известна. Примерно в 2% случаев при проведении биопсии ворсин хориона выявляется частичное несоответствие кариотипов плаценты и плода, что впоследствии, как правило, сочетается с «необъяснимыми» случаями внутриутробной задержки роста плода [11]. При наличии ограниченного плацентарного мозаицизма хромосомных нарушений плода, как правило, не находят.
Приводим описание клинического наблюдения монозиготной тройни, при которой проявления тканевого хромосомного мозаицизма повлекли тяжелые нарушения течения беременности.
Материал и методы исследования
Исследованные ткани представляли собой производные различных зародышевых листков: плацента – производное трофобласта, сердце – преимущественно производное мезодермы; печень и тимус – производные эктодермы и эндодермы; головной мозг – преимущественно производное эктодермы. Молекулярно-цитогенетическое исследование проведено методом FISH (fluorescence in situ hybridization).
Предобработка препаратов тканевых срезов пепсином перед процедурой FISH проводилась в соответствии с методикой, рекомендуемой фирмой-производителем зондов (Abbot Molecular, USA). Перечень выявленных пороков развития плодов в соответствии с базами данных OMIM, POSSUM был ассоциирован с аномалиями хромосом 18,9,6,1, Х, что легло в основу выбора зондов при FISH-анализе срезов различных тканей.
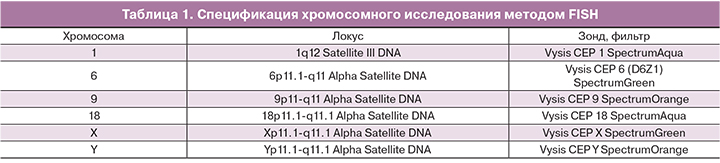
В результате для исследования с использованием метода FISH-анализа были выбраны центромерные зонды на хромосомы X, Y, 18, 9, 6, 1 (Abbot Molecular, USA) (табл. 1).
Трехцветная FISH проведена на двух срезах c зондами на X, Y и 18-й хромосомы и с зондами на 1, 6, и 9-й хромосомы. Процедура FISH (fluorescence in situ hybridization) и отмывка препаратов проведена в соответствии с рекомендациями фирмы производителя (Abbott Molecular, USA). Для заключения препаратов и одновременного окрашивания ядер использован раствор флуоресцентного красителя DAPI I 125 мкг/мл производства той же фирмы. Исследование препаратов проводился на микроскопе «Carl Zeiss», оборудованном CCD-камерой и программой FISH-анализа. Для оценки мозаицизма подсчет сигналов проводился не менее чем на 100 ядрах.
Результаты и обсуждение
Клиническое описание
Пациентка Р., 35 лет, наблюдалась в связи с беременностью монохориальной триамниотической тройней, наступившей в результате экстракорпорального оплодотворения (ЭКО). В анамнезе у пациентки детские инфекции, язвенная болезнь 12-перстной кишки, мочекаменная болезнь. В течение 10 лет страдает вторичным бесплодием вследствие удаления маточных труб по поводу двух внематочных беременностей.
Состоит во втором неродственном браке. Мужу 36 лет, здоров, брак второй. Фенотипы супругов и генеалогия без особенностей. Кариотипы супругов в норме, сбалансированных хромосомных аберраций не выявлено.
Данная беременность наступила в результате ЭКО и переноса одного эмбриона. В I триместре установлено наличие спонтанной монохориальной триамниотической тройни, наблюдались явления раннего токсикоз и анемии сложного генеза. II триместр осложнился угрозой прерывания беременности, была произведена хирургическая коррекция истмико-цервикальной недостаточности. При ультразвуковых исследованиях грубых аномалий развития плодов не выявлено, имелось выраженное многоводие и единственная артерия пуповины III плода. В 19–20 недель отмечено ухудшение общего состояния беременной, отеки, артериальная гипертензия, признаки внутрипеченочного холестаза.
В связи с нарастанием клинических проявлений преэклампсии на фоне внутрипеченочного холестаза и анемии при наличии многоплодной беременности по решению консилиума было проведено прерывание беременности по медицинским показаниям на сроке 19–20 недель путем операции малого кесарева сечения.
Морфологические исследования плодов и последов
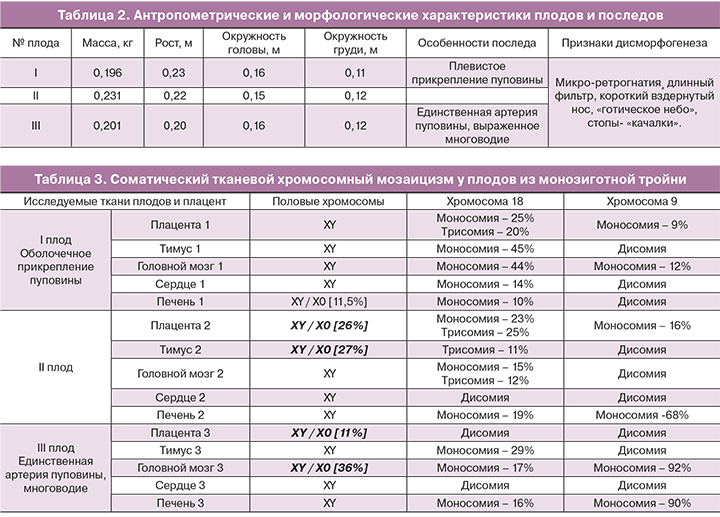
Извлечены три мертвых плода массой 196 г, 231 г и 206 г; отмечено выраженное многоводие III плода. При патологоанатомическом исследовании установлено: все плоды мужского пола, определяется значительное общее сходство внешнего облика и наличие множественных признаков дисэмбриогенеза (табл. 2). По морфологическим признакам гестационный возраст I и III плодов соответствовал 17–18 неделям гестации, а возраст II плода – 18–19 неделям гестации.
Макроскопическое изучение последа и гистологическое исследование образцов тканей проводили в соответствии с общепринятыми рекомендациями [12, 13]. Послед представлял собой три интимно соединенные плаценты с тремя амниотическими плодовместилищами и пуповинами; имелось оболочечное (плевистое) прикрепление пуповины I плода и единственная артерия пуповины III плода. На основании морфологической оценки данных признаков был подтвержден монозиготный характер тройни, разделившейся на постзиготическом этапе эмбрионального развития, когда смогли сформироваться отдельные последы и произойти диссоциированное развитие III плода. Это мог быть этап инвазии бластоцисты и начала плацентации в период 7–14-го дня беременности от зачатия (5–6-я пресомитная стадия развития) [14].
При патологоанатомическом исследовании грубые врожденные пороки развития внутренних органов плодов не определялись, однако присутствовала гипоплазия сердца, почек и надпочечников. Макроскопически гонады соответствовали яичкам, что было подтверждено при гистологическом исследовании.
У всех плодов имелись сходные признаки дисэмбриогенеза – микроретрогнатия¸ длинный фильтр, короткий вздернутый нос, «готическое небо», стопы-«качалки» (рис. 1, 2). При анализе сочетания данных признаков с использованием баз данных OMIM, POSSUM позволило предположить наличие у плодов хромосомного дисбаланса – синдрома Эдвардса, частичных моносомий и трисомий хромосомы 9 ,6 и др. [15–17].
При визуальной оценке плодов на пренатальном этапе и при морфологическом и синдромологическом исследовании после рождения грубых анатомических аномалий развития выявлено не было. Однако имеющиеся малые признаки дисморфогенеза позволили предположить наличие хромосомного дисбаланса, что впоследствии было подтверждено методами лабораторного генетического анализа. Пренатальная визуальная диагностика с применением стандартного двумерного ультразвукового исследования (УЗИ) оказалась неэффективна для детальной визуализации малых признаков дисэмбриогенеза. Для дородовой диагностики генетических синдромов с малой анатомической выраженностью более эффективны методы объемного 3D/4D УЗИ с синдромологической оценкой фенотипа плода.
Молекулярно-цитогенетическое исследование тканей методом FISH
В результате молекулярно-цитогенетического исследования срезов образцов различных тканей плодов и последа с использованием метода FISH установлено наличие множественного тканевого мозаицизма по хромосомам Y, 18 и 9 (табл. 3, рис. 3).
Исследование тканей всех плодов на анеуплоидии хромосом 1 и 6 аномалий не выявило. В большинстве тканей всех трех плодов обнаружена анеуплоидия по хромосоме 18, преимущественно в виде моносомии по хромосоме 18. Однако наблюдалась также и трисомия по хромосоме 18. Эти данные хорошо коррелируют с фенотипическими признаками синдрома Эдвардса у плодов. Полная моносомия по хромосоме 18 очевидно является летальной; частичные моносомии 18 сопровождаются грубыми нарушениями развития плода [17, 18]. Однако в данном случае мозаичный вариант моносомии 18 позволил беременности прогрессировать до II триместра. Второй по значимости находкой оказалась моносомия хромосомы 9, которая преимущественно определялась в тканях III плода (головной мозг и печень). Частичные моносомии 9 (в составе различных хромосомных транслокаций) приводят к формированию множественных аномалий развития и задержке развития ребенка [15, 16], а полная моносомия 9 летальна. У III плода отмечены более выраженные клинические проявления врожденных пороков развития – единственная артерия пуповины, выраженное многоводие. Однако в ткани плаценты III плода моносомия 9, а также анеуплоидия 18 не была обнаружена, что, вероятно, и позволило III плоду развиваться до II триместра беременности. Не исключено, что в клетках плода имелись хромосомные перестройки, включающие фрагменты 9-й хромосомы, не определяемые используемым центромерным FISH-зондом.
Интересным фактом, установленным при данном наблюдении, оказалось почти полное отсутствие анеуплоидий по исследованным хромосомам в ткани сердца (миокарде) у всех трех плодов, что очевидно, дало возможность для роста и развития до срока беременности 19–20 недель. Является ли такая находка случайным событием, или же производные мезодермы менее подвержены процессу хромосомного мутагенеза – этот факт требует дальнейших наблюдений и исследований. Кроме того, метод FISH-анализа, использованный в данном наблюдении, не позволяет судить о наличии генетической патологии в форме однородительской изодисомии в диплоидных клетках.
Максимальное количество анеуплоидных клеток имелось в тканях производных эктодермы и эндодермы – в печени, головном мозгу, тимусе плодов. Отмечено выраженное несовпадение генетических характеристик плаценты и тканей плодов, особенно значительное у III плода. Плацента III имела незначительную долю мозаицизма по моносомии Х, а по хромосомам 18, 9 и 1 была диплоидной. В то же время ткани печени и головного мозга III плода содержали до 92% клеток с моносомией по хромосоме 9. Данный факт подтверждает феномен неполного соответствия генотипов трофобласта и плода, неоднократно описанный в литературе, что может быть источником диагностических ошибок при проведении инвазивной пренатальной диагностики только по клеткам хориона или плаценты. Использование методов молекулярного кариотипирования последнего поколения – молекулярного микроматричного анализа ДНК, метода секвенирования ДНК (next generation sequencing – NGS) – повышают информативность и надежность пренатальной диагностики [19].

Связь между хромосомным мозаицизмом, ограниченным плацентой и развитием тяжелой акушерской патологии активно изучается. Показано влияние хромосомной несбалансированности плаценты на проявления ранней преэклампсии, внутриутробной задержки роста плода, развитие HELLP-синдрома, многоводия и маловодия [19, 20–26]. Роль соматического тканевого мозаицизма плода остается вопросом малоизученным.
В случаях сочетания хромосомного дисбаланса и плаценты, и плода закономерно ожидать более выраженных и ранних клинических проявлений акушерской патологии.
Имеющийся множественный хромосомный мозаицизм трех плодов и последов у данной пациентки мог служить первичным фоном для неблагополучного течения беременности и ассоциировался с нарастанием клинических проявлений преэклампсии в сочетании с внутрипеченочным холестазом. Предполагается, что одним из важных звеньев патогенеза нарушений развития плаценты при хромосомных нарушениях могут являться оксидативный стресс и митохондриальная дисфункция, которые на постнатальном этапе приводят к фрагментации ДНК [27].
Спектр структурных особенностей плаценты с хромосомными аномалиями довольно широк. Это уменьшение объема плаценты, снижение васкуляризации, фиброзирование ворсин, отставание в развитии ворсинчатого дерева, наличие кист в хориальной пластинке и участков буллезного эпидермолиза [28, 29]. В образцах плаценты, взятых от пациентов с трисомиями 13, 18 или 21 описаны участки гипотрофии, незрелости, отека ворсинчатого дерева, кисты трофобласта и минерализации базальной пластинки [30, 31].
Заключение
Соматический тканевой хромосомный мозаицизм является одним из универсальных патологических механизмов нарушения развития тканей организма, в том числе, тканей плодного яйца. Частичный хромосомный дисбаланс может быть одним из нераспознанных этиологических факторов пороков развития плода и тяжелой акушерской патологии (фето-плацентарной недостаточности, преэклампсии, внутриутробной задержки развития плода, антенатальной гибели плода).
Сложность пренатального диагноза мозаичных форм хромосомных нарушений диктует необходимость совершенствования методов дородовой диагностики. Визуальная диагностика признаков дисэмбриогенеза наиболее эффективна при использовании методов объемного ультразвука с использованием элементов синдромологического анализа фенотипа плода. Ранняя манифестация осложнений течения беременности – преэклампсии, задержки роста плода в первой половине беременности могут служить дополнительными показаниями для детального генетического исследования плода с применением инвазивных манипуляций и методов молекулярного кариотипирования.



