По классическим представлениям, развитие преэклампсии (ПЭ) происходит в две стадии [1, 2]. На первом этапе возникает нарушение плацентации, включающее неполную инвазию трофобласта в децидуальную оболочку матки и нарушение ремоделирования маточных спиральных артерий. В результате нарушается перфузия плаценты, в ней возникает гипоксия и окислительный стресс [3].
Вторая стадия заболевания характеризуется клиническими проявлениями в виде артериальной гипертензии, протеинурии, отеков, которые обусловлены повреждением эндотелия и системным воспалением [3–5]. Несмотря на активное изучение патофизиологических процессов, связанных с ПЭ, до сих нет однозначных представлений об этиологии этого заболевания. Неизвестно, что в патогенезе ПЭ является причиной, а что – следствием. Существуют различные версии того, какие факторы могут связывать первую и вторую стадию патогенеза заболевания. Не исключено, что в разных случаях действительно имеют место различные механизмы [6–8].
Поиски фенотипически и патогенетически различных форм ПЭ продолжаются, в том числе с использованием современных биоинформатических методов исследования, позволяющих оценивать большие объемы данных [8–11].
В рамках представлений о ранней и поздней ПЭ, как о разных заболеваниях, особый интерес представляет изучение их факторов риска и особенностей клинического течения, а также поиск возможностей прогнозирования развития ПЭ на ранних этапах беременности.
Цель исследования создание прогностической модели индивидуального риска развития ПЭ на основании клинико-анамнестических данных.
Материал и методы исследования
Работа выполнялась на базе ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России. В исследование были включены 320 женщин. В группу 1 (основную) вошли 160 пациенток с ПЭ, среди которых было 48 с ранней ПЭ (1.1) и 112 – с поздней ПЭ (1.2). Контрольная группа (n=160) пациенток была сформирована методом подбора.
Диагноз ПЭ устанавливался в соответствии с критериями указанными в Федеральных клинических рекомендациях РОАГ «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» [12].
Критериями включения в исследование являлись одноплодная беременность, отсутствие резус-конфликта в текущей беременности, использования донорской яйцеклетки, онкологических заболеваний, трансплантации внутренних органов в анамнезе, а также наличие информированного согласия на включение в исследование.
Все женщины были обследованы в соответствии с приказом Минздрава России от 12 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий)». Проведено ретроспективное исследование случай-контроль.
Конечной точкой исследования являлось корректированное отношение шансов (ОШкор) развития ранней и поздней ПЭ в зависимости от выявленных факторов риска. Оценка проводилась с помощью многофакторного анализа – логистической регрессии. На основании полученных данных строилась модель расчета индивидуального риска развития ПЭ.
 Статистическая обработка данных выполнялась на индивидуальном компьютере с помощью электронных таблиц Microsoft Excel, языка программирования R и пакета статистических программ Statistica 10 (США).
Статистическая обработка данных выполнялась на индивидуальном компьютере с помощью электронных таблиц Microsoft Excel, языка программирования R и пакета статистических программ Statistica 10 (США).
Для качественных данных производился расчет ОШ в связи с намерением установления причинно-следственной связи. Для сравнения качественных данных в 2 и более группах и установления значимых различий между ними использовали тест χ2, для вычисления которого прибегали к построению таблиц сопряженности, а также точный критерий Фишера для небольших выборок.
Перед проведением сравнительного анализа количественных данных в исследуемых группах определяли вид распределения данных (тест Колмогорова–Смирнова, графический анализ данных). При нормальном виде распределения данных определяли среднее значение со стандартным отклонением (СО), для оценки различий в группах применяли методы параметрической статистики (t-тест для сравнения данных в 2 группах или дисперсионный анализ (англ. – Analysis of variance, ANOVA) для сравнения данных в нескольких группах). При ненормальном распределении данных определяли медиану с интерквартильным размахом, для оценки различий в группах применяли методы непараметрической статистики (тест Манна–Уитни для сравнения данных в 2 группах или тест Крускала–Уоллиса для сравнения данных в нескольких группах).
Для построения модели развития ПЭ использовался метод логистической регрессии. При этом производился расчет ОШкор и построение ROC-кривой (англ. – receiver operating characteristic) для контроля множественных конфаундеров.
Различия между статистическими величинами считали статистически значимыми при уровне достоверности p<0,05.
Результаты исследования и обсуждение
Однофакторный анализ
Средний возраст включенных в исследование женщин составил 32,6±5,3 года, 31,9±5,9 года, 30,5±5,6 года (р=0,0198) в группах соответственно, что подтверждает представления о связи развития ПЭ с возрастом женщины. При анализе антропометрических данных не было выявлено статистически значимых различий между группами. Данные показатели составили соответственно для групп 71,2±16,3 кг, 67,3±16,6 кг, 67,1±15,1 кг для веса (р=0,2521), и 165,0±5,7 см, 166,6±6,2 см, 165,9±5,6 см для роста (р=0,2270). Индекс массы тела (ИМТ) составил 26,2±6,5, 24,3±5,4 и 24,4±5,2 в группах соответственно (р=0,2784). При изучении менструальной функции (возраст менархе, длительность менструального цикла, продолжительность менструального кровотечения) не было выявлено статистически значимых различий между группами (ANOVA, p>0,05). В структуре гинекологической заболеваемости не было выявлено статистически значимой разницы между группами 1.1, 1.2 и 2, также как и при анализе данных о частоте оперативных вмешательств на органах малого таза. При оценке акушерского анамнеза, включавшего общее число беременностей, родов, самопроизвольных выкидышей, искусственных абортов, эктопических беременностей, не было выявлено значимых различий в исследуемых группах. Структура сопутствующих экстрагенитальных заболеваний (кроме хронической артериальной гипертензии (ХАГ)) также значимо не отличалась между группами.
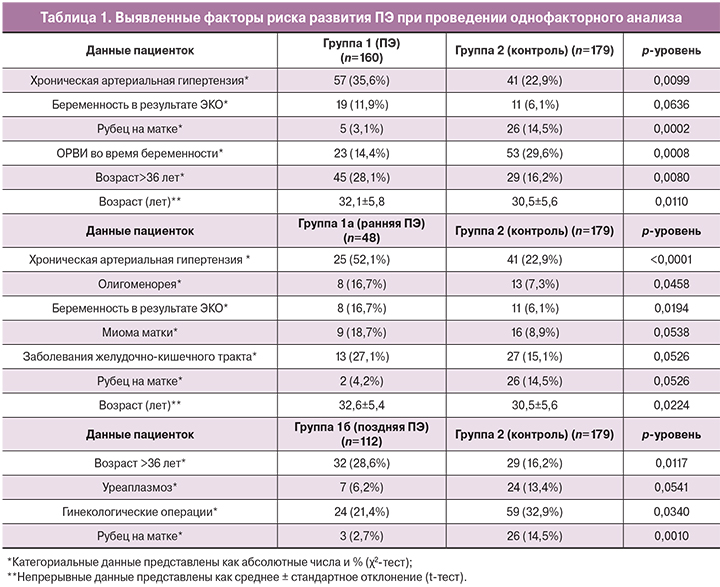
При сравнении пациенток с ПЭ с контрольной группой при проведении однофакторного анализа было выявлено лишь 2 фактора риска, считающихся доказанными, а именно ХАГ и возраст женщины. При этом возраст был представлен в виде бинарной переменной с нахождением порога отсечки (> 36 лет), при которой созданная модель была максимально достоверной (ROC анализ, площадь под кривой (AUC=64,6%)). Погранично значимыми оказалась корреляция ПЭ с ЭКО.
Вместе с тем, нам не удалось обнаружить связь с такими принятыми факторами риска ПЭ, как первые роды, ожирение и заболевания почек. Невозможность получить статистически значимые данные о связи ПЭ с многоплодием, семейным анамнезом ПЭ, наличием тромбофилии в анамнезе, сахарного диабета, системной красной волчанкой, по-видимому, объясняется небольшим количеством пациентов с наличием данных факторов риска в выборке (табл. 1).
Кроме того, были выявлены данные о более частом развитии ПЭ у женщин с меньшим количеством ОРВИ во время беременности и наличием рубца на матке. То есть в однофакторном анализе ОРВИ и рубец на матке явились протективными факторами развития ПЭ, что не может быть объяснено с точки зрения патофизиологии заболевания. Возможно, данные факторы явились конфаундерами, и их роль нивелируется при проведении многофакторного анализа.
При проведении однофакторного анализа было выявлено, что ранняя ПЭ значимо чаще по сравнению с контрольной группой развивалась на фоне ХАГ, ЭКО, а также у пациенток более старшего возраста (табл. 1). Эти данные соответствуют результатам, полученным рядом авторов [13, 14]. Среди погранично значимых оказались ассоциации ранней ПЭ с миомой матки, заболеваниями желудочно-кишечного тракта.
При сравнении пациенток с поздней ПЭ с контрольной группой при проведении однофакторного анализа было выявлено, что поздняя ПЭ чаще встречалась у женщин более старшего возраста. При этом в отличие от данных других авторов [13] значимых различий между возрастом пациенток с поздней и ранней ПЭ выявлено не было (табл. 1).
С целью уменьшения ошибки, вызванной действием вмешивающихся факторов (конфаундеров) был проведен многофакторный анализ с помощью логистической регрессии. Для ПЭ было выявлено 2 фактора риска – ХАГ и возраст старше 36 лет (табл. 2).

На основании данных многофакторного анализа была построена формула для расчета индивидуального риска ПЭ на основании указанных факторов риска.
Вероятность развития ПЭ в зависимости от выявленных факторов риска:
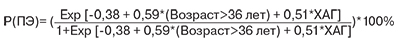
При проведении анализа для ранней и поздней ПЭ единственным фактором риска для ранней ПЭ оказалась ХАГ. ОШкор для ПЭ при наличии ХАГ оказалось равным 3,7 (95% ДИ=1,9; 7,1).
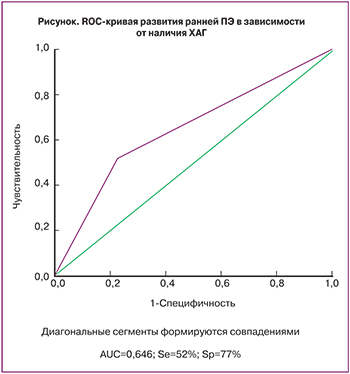
При построении ROC-кривой AUC составила 0,646. Чувствительность модели составила 52%; специфичность – 77% (рисунок).
Несмотря на то что в результате многофакторного анализа был выявлен только один фактор для прогнозирования ранней ПЭ, полученная чувствительность и площадь под кривой близки к результатам, полученным другими авторами с учетом лабораторных и инструментальных данных [15–18]. Полученные данные подтверждают рекомендации ACOG от сентября 2015 года [19], в которых отдается предпочтение сбору анамнестических данных вместо рутинной инструментальной и лабораторной диагностики в связи с низкой прогностической ценностью положительных результатов имеющихся тестов. Возможно было бы увеличить количество значимых факторов и прогностическую ценность теста путем увеличения объема выборки.
При проведении многофакторного анализа для выявления факторов риска при поздней ПЭ было выявлено 3 значимых фактора: возраст старше 36 лет, рубец на матке и ОРВИ во время беременности (табл. 2).
Связь возраста с ПЭ находится в соответствии с данными других авторов. ОШкор (возраст>36 лет) =2,0 (95% ДИ=1,1; 3,7).
Заключение
Таким образом, ПЭ – тяжелое состояние, при котором повышен риск развития акушерских осложнений, как со стороны матери, так и со стороны плода/новорожденного. Несмотря на большие финансовые и интеллектуальные усилия ведущих мировых исследователей, этиология заболевания до сих пор неизвестна. В последние годы активно разрабатывается концепция ПЭ как синдрома, возникающего при разных нозологических состояниях. Одной из идей в рамках данной концепции является разделение ПЭ на раннюю и позднюю форму [20].
При сравнении двух форм ПЭ были выявлены различия в связанных с ними факторами риска, что согласуется с данными, полученными другими авторами [13]. Большая частота материнских и неонатальных осложнений при ПЭ по сравнению с контролем, а также при ранней ПЭ по сравнению с поздней ПЭ, отражает необходимость поиска способов раннего прогнозирования и предупреждения развития заболевания.
Таким образом, в рамках работы предпринята попытка построения модели для расчета индивидуального риска развития ПЭ на основании клинико-анамнестических данных, направленная на выделение группы риска динамического наблюдения и лечения для снижения акушерских осложнений и улучшения перинатальных исходов.



