Работа частично поддержана Государственным контрактом Министерства образования и науки РФ №16.522.12.2009 от 29.09.2011.
В последние годы наблюдается значительный рост абдоминального родоразрешения. Так, в перинатальных центрах России частота кесарева сечения (КС) достигает 30–40% (в среднем составляет 15–16%) и не имеет тенденции к снижению [12, 15]. Согласно данным В.И. Краснопольского и Л.С. Логутовой, в среднем около 30% женщин после абдоминально- го родоразрешения планируют повторную беременность [9].
До настоящего времени отсутствуют надежные методы оценки состояния рубца матки после предыдущего кесарева сечения, в связи с чем повторное родоразрешение также проводится оперативным путем, хотя в ряде случаев возможно проведение родов через естественные родовые пути даже при наличии рубца матки.
Показано, что генетически детерминированное снижение механической прочности соединительной ткани потенциально может приводить к несостоятельности рубца, что позволяет выявить соответствующую группу риска [8, 13, 14].
Целью исследования явилось повышение эффективности оценки состояния рубца матки после предыдущего кесаревого сечения путем разработки комплексной математической модели.
Материали методы исследования
В исследование включены 160 беременных в возрасте от 18 до 40 лет с рубцом на матке после предыдущей операции кесарева сечения, которые были разделены на 2 группы. В основную группу вошли 80 женщин с неполноценным рубцом (НР) и 80 пациенток с полноценным рубцом (ПР) составили группу сравнения.
Поскольку ни одного случая разрыва матки не наблюдалось, то в качестве клинического исхода при математическом моделировании рассматри- вали наличие признаков неполноценности рубца. Оценку состояния рубца проводили интраопераци- онно с последующим подтверждением при морфологическом исследовании ткани рубца и прилежа- щего миометрия.
Интраоперационная оценка области нижнего сегмента матки (НСМ) проводилась визуально во время повторной операции КС. Полноценные рубцы, как правило, не визуализировались или были представлены в виде соединительнотканного рубца толщиной 3–5 мм. НР были представлены в виде локального или тотального истончения миометрия менее 2 мм.
До родоразрешения всем пациенткам было проведено ультразвуковое исследование. Критерием неполноценности рубца считалось локальное или тотальное истончение миометрия менее 2 мм.
Для проведения генетического исследования брали кровь из кубитальной вены по стандартной методике. В качестве потенциальных молекулярно-генетических предикторов несостоятельности рубца были выбраны следующие однонуклеотидные генные полиморфизмы (SNP) (табл. 1).
Таблица 1. Список изученных полиморфизмов.
Определение замен одиночных нуклеотидов проводили модифицированным методом «примыкающих проб» (adjacent probes, kissing probes), используя оригинальные олигонуклеотиды. Полимеразную цепную реакцию и определение температуры плав- ления олигонуклеотидных проб проводили с помо- щью детектирующего амплификатора ДТ-96 (ООО «НПО ДНК-Технология», Россия). Статистическая обработка данных проводилась с помощью свободно распространяемого программного продукта WINPEPI версии 9.7 (J.H. Abramson, WINPEPI; PEPI- for-Windows: computer programs for epidemiologists. Epidemiologic Perspectives & Innovations 2004, 1:6). Для определения статистической значимости различий применяли точный двухсторонний критерий Фишера и U-тест Манна-Уитни для несвязанных совокупностей. Отношение шансов (OR) приведено с 95% доверительным интервалом (CI).
Для построения канонической линейной дискриминантной функции (КЛДФ) был выполнен дискриминантный анализ с использованием пакета программ SPSS Statistics версии 17.0 (США). Для оценки эффективности классификации и качества модели был проведен ROC-анализ. Данный вид анализа предназначен для оценки результатов бинарной классификации. При этом предполагается, что у классификатора имеется некоторый параметр, варьируя которым возможно разделение на два класса. Значение этого параметра, которое позволяет разделять классы, называют порогом или точкой отсечения (cut-off value). ROC-кривая (Receiver Operator Characteristic) показывает зависимость количества верно классифицированных положительных результатов (истинно положительных) от количества неверно классифицированных отрицательных результатов (ложноотрицательных). Для идеального классификатора график ROC-кривой проходит через верхний левый угол, где доля истинно положительных случаев составляет 100% (идеальная чувствительность), а доля ложноположительных результатов равна нулю. Поэтому чем ближе кривая к верхнему левому углу, тем выше предсказательная способность модели. Наоборот, чем меньше изгиб кривой и чем ближе она расположена к диагональной прямой (опорной линии), тем менее эффективна модель. Диагональная линия соответствует “бесполезному” классификатору, то есть полной неразличимости двух классов с помощью данного классификатора. Для сравнения нескольких ROC-кривых используется оценка площади под кривыми (AUC – Area Under Curve). Поскольку модель всегда характеризуется кривой, расположенной выше положительной диагонали, то оценивается значение от 0,5 («бесполезный» классификатор) до 1,0 («идеальная» модель). В нашей работе непосредственная оценка эффективности модели была получена с помощью расчета численного показателя AUC методом трапеций.
Для установления уровня отсечения (cut off) проводился пересмотр значений классификационной функции от максимального до минимального значения. Для каждого значения проводилось разделение групп с непосредственным расчетом чувствительности и специфичности. Критерием выбора порога отсечения выбрано требование максимальной чувствительности при заданной специфичности модели
Результаты исследования
Возраст беременных, включенных в исследование, колебался от 22 до 45 лет и составил в среднем 32,9±1,2 и 33,9±0,9 года соответственно по группам.
Отклонений от популяционных норм при анализе массо-ростовых отношений у беременных не выявлено. Средняя масса тела по группам составила 77,8+2,14 и 76,7+2,15 кг, средний рост – 166,2+3,2 и 165,0+4,6 см соответственно.
Принимая во внимание, что одним из важных факторов, определяющих течение репаративных процессов в матке, является исходное здоровье матери, было изучено состояние здоровья исследуемых беременных, а также особенности соматического и гинекологического анамнезов.
Различий по частоте перенесенных инфекционных заболеваний в детстве в группах не выявлено, однако в основной группе чаще отмечались скарлатина (11,3%) и грипп (36,3%) (OR=1,42; 95% CI 0,55–3,73 и OR=1,4; 95% CI 0,8–2,5 соответственно), а во второй – корь (21,3%), краснуха (55,0%) и эпидемический паротит (23,8%) (OR=54,6; 95% CI 0,2–1,2; OR=0,62; 95% CI 0,36–1,09; OR=0,63; 95% CI 0,3–1,3 соответственно).
В соматическом анамнезе у пациенток основной группы среди заболеваний сердечно-сосудистой системы превалировал ПМК (в 15,0%, OR=6,3; 95% CI 1,6–24,2) и ВСД (в 21,3%, OR=1,2; 95% CI 0,6–2,5).
Среди заболеваний МВС у пациенток основной группы чаще отмечались хронический пиелонефрит (в 16,3%, OR=1,7; CI 3,8–0,7) и хронический цистит (в 8,8%, OR=1,2; CI 3,2–0,4). В
1,3% наблюдений этой группы выявлен нефроптоз. Анализ заболеваний эндокринной системы в группах не выявил достоверных различий в частоте, однако в основной группе несколько чаще встречалась патология щитовидной железы (12%), а также только в этой группе была отмечена патология молочных желез (ФКМ) 1,3%.
Обращает на себя внимание высокая частота миопии в обеих группах (у каждой третьей пациентки), при этом у пациенток основной группы превалировала миопия высокой степени (в 16,3%, OR=3,5; CI 1,3–9,8), в то время как во второй группе – слабой степени (в 15,0%, OR=0,2; CI 0,1–0,6).
Средний возраст наступления менархе в обеих группах был практически одинаков и составил в среднем 12±0,9 года. Продолжительность менструального цикла составила 29,7+0,6 и 29,3+0,6 дня соответственно.
Учитывая высокую частоту инфекционных заболеваний у пациенток обеих групп, был проведен анализ спектра возбудителей. Достоверных различий выявлено не было, однако у пациенток основной группы преобладала бактериальная флора (уреаплазма) (в 8,8%, OR=1,8; CI 0,6–5,5), микоплазма (в 3,8%, OR=1,4; CI 0,3–7,0) и дрожжеподобные грибы рода Candida (в 8,8%, OR=1,8; CI 0,6–5,5), в то время как во второй группе вирусные поражения: ВПГ (в 17,5%, OR=0,54; CI 0,2–1,2) и ЦМВ (в 10%, OR=0,3; CI 0,1–1,1).
При изучении структуры гинекологической заболеваемости была отмечена высокая часто- та цервицита в первой группе (в 30%, OR=1,25; CI 0,7–2,3) и хронического сальпингоофорита (в 15%, OR=0,9; CI 0,4–2,0). Вместе с тем у пациенток I группы в 3 раза чаще встречалась дисфункция яичников (в 7,5%, OR=2,9; CI 0,7–12,2). Однако достоверно чаще во второй группе преобладали вагинит (в 16,3%, OR=0,4; CI 0,2–1,0) и миома матки (в 23,8%, OR=0,4; CI 0,2–0,9).
Особый интерес представляло изучение течения настоящей беременности. У пациенток основной группы течение I триместра чаще осложнялось ранним токсикозом (в 45%, OR=1,6; CI 0,9–2,8). Во II триместре у пациенток данной группы чаще отмечалась угроза выкидыша (в 35%, OR=1,3; CI 0,7–2,3) и ИЦН (в 15%, OR=3,1; CI 1,1–8,6), в связи с чем в большинстве случаев проводилась хирургическая коррекция. В III триместре течение беременности у пациенток основной группы чаще осложнялось угрозой преждевременных родов (в 21,3%, OR=1,2; CI 0,6–2,5), плацентарной недостаточностью, сопровождающейся ЗРП (в 16,3%, OR=3,7; CI 0,9–15,0) и анемией (в 18,8%, OR=1,9; CI 0,8–4,3).
Учитывая наличие рубца на матке, у пациенток обеих групп перед родоразрешением проводилось УЗИ, при этом в обеих группах были выявлены признаки неполноценности в виде истончения рубца матки до 1 мм у 69,5 и 8,0% соответственно.
У всех женщин родоразрешение было прове- дено путем операции кесарева сечения. Следует отметить, что основными показаниями к родораз- решению явились начало родовой деятельности (в 31,3 и 23,7%), подозрение на несостоятельность рубца на матке (в 25,0 и 5,0%) и преждевременное излитие околоплодных вод (в 8,8 и 10%).
Средняя кровопотеря при родоразрешении составила 784,5±51,2 мл и 668,4±32,3 мл в первой и второй группах соответственно.
Интраоперационно неполноценность рубца на матке у пациенток основной группы была выявлена в 84,2% наблюдений (OR=30,1; CI 24,6–33,3). Расположение плаценты по передней стенке матки в основной группе отмечалось у 45% беременных (OR=1,4; CI 2,5–0,8). При изучении особенностей течения послеродового периода не выявлено статистически значимых различий у пациенток обеих групп. Однако у пациенток основной группы чаще диагностировали образование гематом (в 5,0%) и субинволюцию матки (6,3%).
Течение раннего неонатального периода было оценено у 160 новорожденных. Средняя масса новорожденных составила 3185,0+101,2 г в основной группе и 3288,1+98,4 г в группе сравнения. Средняя оценка состояния новорожденных при рождении по шкале Апгар в группах не различалась.
Дети от матерей основной группы чаще рождались в состоянии асфиксии (легкой и средней степеней тяжести). Течение раннего неонатального периода у них чаще осложнялось развитием неонатальной желтухи (28,8%), транзиторного тахипноэ (10%), врожденной пневмонией (13,8%) (р<0,05). При этом только в основной группе были выявлены пиелоэктазия (2,5%), врожденный порок сердца (2,5%), внутричерепные кровоизлияния (3,8%) и синдром угнетения ЦНС (2,5%). В группе сравнения преобладали врожденный везикулез (7,5%), ВУИ (3,8%), при этом только в этой группе были выявлены синдром гипервозбудимости (6,3%), дискинезия желчевыводящих путей (6,3%) и токсическая эритема (3,8%) (р<0,05).
Таким образом, у пациенток с неполноценным рубцом матки отмечена связь НР с наличием таких клинических признаков, как миопия и пролапс митрального клапана, также имеет место отягощенный акушерский и соматический анамнезы, которые, по-видимому, вносят вклад в формирование рубца на матке. Течение же беременности у данных пациенток сопровождается высокой частотой развития таких осложнений, как угроза прерывания, ИЦН, ПН, что обусловливает актуальность проведения исследований по оптимизации тактики ведения пациенток с рубцом на матке с определением срока и способа родоразрешения.
При ультразвуковом исследовании пациенток основной группы признаки неполноценности рубца были выявлены только у 30 (37,5%) пациенток, которые были расценены как истинно положительные. В то же время в группе сравнения данные признаки определялись у 14 (17,5%) беременных, которые были расценены как ложно- положительные. Таким образом, при достаточно высокой специфичности (82,5%) ультразвуковое исследование обладало очень низкой чувствительностью (37,5%).
Использование дополнительных клинических предикторов неполноценности рубца, выявленных в предыдущих исследованиях [2–7, 11] существенно не повысило чувствительность диагностики. При проведении дискриминантного анали- за были отброшены все клинические критерии, кроме данных УЗИ.
Учитывая, что генетическая предрасположенность к нарушению структуры соединительной ткани является фактором риска несостоятельности рубца, нами была построена математическая модель на основании генетических факторов риска. С помощью дискриминантного анализа была подобрана каноническая линейная дискриминантная функция (КЛДФ), уравнение которой имело вид:
КЛДФгенетика =0,949×[VEGFA634]+1,1010×[VEGF A936]+0,641×[MMP2]-1,089×[ESR1]-2,40 где:
[MMP2] – число аллелей A полиморфизма MMP2: -735 C>A
[VEGFA634] – число аллелей C полиморфизма VEGFA: -634 (-94) G>C
[VEGFA936] – число аллелей T полиморфизма VEGFA: 936 C>T
[ESR1] – число аллелей A полиморфизма ESR1: 2014 G>A (Thr594Thr)
Для оценки диагностических возможностей модели с использованием только генетических предикторов (КЛДФгенетика) был выполнен ROC- анализ (рис. 1). Площадь под ROC-кривой (AUC) составила 0,739 (0,639–0,839), р=0,05. В качестве критерия выбора точки отсечения (cut-off) было задано требование максимальной чувствительности при специфичности не ниже специфичности ультразвукового исследования (82,5%). Точкой отсечения для КЛДФгенетика выбрано значение 0. Значения КЛДФгенетика больше cut-off свидетельствовало о неполноценности рубца.
Чувствительность модели в точке отсечения составила 46% при специфичности 84%, что позволило существенно улучшить предсказательную способность.
Следующим этапом было создание комплексной модели, включающей как генетические, так и клинические факторы. При включении в модель результатов ультразвукового обследования была получена следующая КЛДФ:
КЛДФгенетика+УЗИ=0,886×[VEGFA634]+1,26× [УЗИ]+1,102×[VEGFA936]+0,48×[MMP2]-
1,113×[ESR1]-2,533, где:
[УЗИ] – истончение области рубца, по данным УЗИ (1, если толщина <2 мм и при толщине 2 мм и более)
[MMP2] – число аллелей A полиморфизма MMP2: -735 C>A
[VEGFA634] – число аллелей C полиморфизма VEGFA: -634 (-94) G>C
[VEGFA936] – число аллелей T полиморфизма VEGFA: 936 C>T
[ESR1]– число аллелей A полиморфизма ESR1: 2014 G>A (Thr594Thr)
Площадь под ROC-кривой (AUC) составила 0,799 (0,708–0,891), р=0,001 (рис. 1). В качестве критерия выбора точки отсечения (cut-off) было задано требование максимальной чувствительности при специфичности не ниже специ- фичности ультразвукового исследования (82,5%).
Точкой отсечения для КЛДФгенетика+УЗИ выбрано значение 0. Значения КЛДФгенетика+УЗИ больше cut-off свидетельствовало о неполноценности рубца. Чувствительность модели в точке отсечения составила 59,3% при специфичности 89,2%.
Частота встречаемости основных клинических признаков, молекулярно-генетических маркеров и результаты классификации с помощью рассмотренных моделей представлены в табл. 2.
Таблица 2. Частота встречаемости основных клинических признаков, молекулярно-генетических маркеров и результаты классификации с помощью разработанных моделей.
Обсуждение
Низкая чувствительность ультразвуковой диагностики для оценки состояния рубца матки отмечалось во многих работах [1, 10,16–22].
Дополнительные клинические признаки неполноценности рубца не являются специфическими и при использовании их в математическом моделировании существенно не изменяют предсказательной способности модели. Использование генетических маркеров, ассоциированных с нарушением структуры и функции соединительной ткани, позволило существенно повысить чувствительность модели. По-видимому, это обусловлено тем, что в модели были учтены такие специфические факторы риска, как генные полиморфизмы, непосредственно связанные с патогенезом несостоятельности рубца [13, 14]. Генетическая предрасположенность к формированию неполноценного рубца не имеет выраженных специфических клинических проявлений и реализуется только под действием провоцирующих факторов, что существенно затрудняет диагностику. Молекулярно- генетическое исследование позволяет заблаговременно выявить данную предрасположенность, что помогает правильно оценить конкретную клиническую ситуацию. В то же время наилучшей предсказательной способностью обладала комплексная модель, использующая как генетические, так и негенетические маркеры, что отражаетмногофакторную природу нарушения гомеостаза соединительной ткани [8].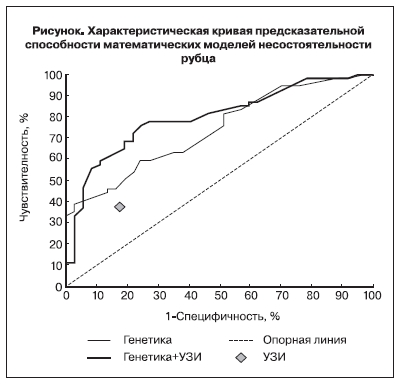
Заключение
Таким образом, использование генетических исследований в комплексе с традиционными методами диагностики позволяет повысить точность определения состояния рубца матки после предыдущей операции кесарева сечения, что необходимо для выбора правильной тактики родоразрешения.



