Изучение первично-множественных злокачественных новообразований (ПМЗН) начинается со времен Авиценны (Ибн Сина), которому принадлежит первое документированное описание случая двустороннего поражения молочных желез. Затем в 1793 году лондонским хирургом Джоном Пирсоном было представлено наблюдение последовательного развития у больной рака правой молочной железы, затем левой и, наконец, рака тела матки. Более широко сообщения о ПМЗН стали появляться в европейской литературе лишь в первой половине XIX века. Однако и по сей день в большинстве своем они носят описательный характер и несут информацию лишь об отдельных клинических случаях или небольших сериях подобных наблюдений.
Напоминаем, что под первичной множественностью опухолей в настоящее время понимают независимое возникновение и развитие у одного больного двух или более новообpазований. При этом пораженными могут быть не только разные органы различных систем, но и парные (молочные железы, легкие и другие), а также мультицентрически один орган [1].
По времени возникновения выделяют синхронные (возникшие одновременно) и метахронные (возникшие через определенные промежутки времени) пеpвично-множественные опухоли. Сочетанный тип возникновения (синхронно-метахронный и метахронно-синхронный) может встречаться при тройной и более комбинации опухолей [1].
Считается, что чаще всего ПМЗН болеют женщины, и при этом у них в основном поражаются органы репродуктивной системы, а опухоли являются преимущественно гормонозависимыми. Более того, отдельно был выделен синдром гормонозависимых аденокарцином в составе полинеоплазии [1].
И все же, по имеющимся наблюдениям, ПМЗН могут быть одним из проявлений различных наследственных синдромов, которые развиваются в большинстве случаев из-за наличия мутаций в генах-супрессорах опухоли [1, 2]. И поэтому риск развития полинеоплазии выше для лиц из наследственно отягощенных семей [1, 2].
Поэтому целью настоящего исследования является изучение клинических и генетических ассоциаций опухолей у женщин с ПМЗН органов репродуктивной для повышения эффективности ранней диагностики, лечения и профилактики этих заболеваний.
Материал и методы исследования
Проанализированы клинические данные 635 больных ПМЗН репродуктивной системы, находившихся на лечении в ФГБУ РОНЦ им. Н.Н. Блохина Минздрава России за последние 20 лет.
Проведен анализ семейного анамнеза больных ПМЗН репродуктивной системы. В исследование были включены 2318 родственников 1-й степени родства больных полинеоплазией старше 20 лет. В качестве контроля использовали группы больных единственным раком аналогичных локализаций. Опытные и контрольные выборки составляли жители г. Москвы и Московской области. Анализ полученных данных осуществлялся как с помощью стандартных статистических методов, так и специальными методами генетического анализа.
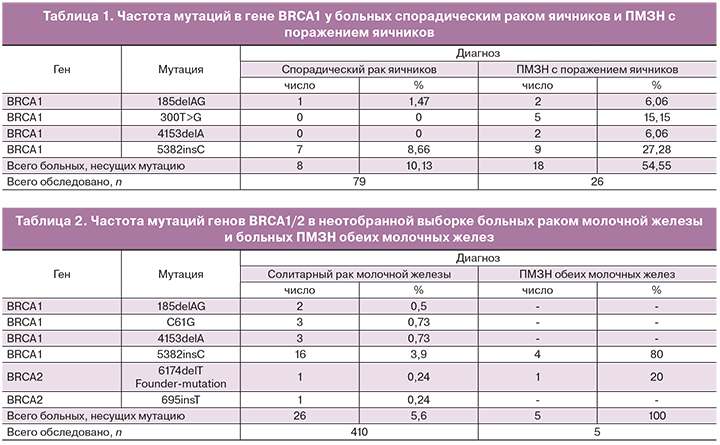
Частоту встречаемости восьми мутаций в генах BRCA1/2 и CHEK2 (185delAG, 300Т>G, 4153delA, 4158A>G и 5382insC в гене BRCA1, 695insT и 6174delTв гене BRCA2, варианта 1100delC в гене CHEK2) определяли с помощью метода биологических микрочипов, сочетающего мультиплексную полимеразную цепную реакцию (ПЦР) и гибридизацию с олигонуклеотидными биочипами, у 520 женщин, находившихся на лечении в ФГБУ РОНЦ им. Н.Н. Блохина Минздрава России.
Также проведено ДНК-тестирование мутаций в генах системы репарации MLH1, MSH2, MSH6 у 35 пациентов с ПМЗН репродуктивной системы и толстой кишки. Определение мутации в генах системы репарации проводилось в клиниках ФГБУ РОНЦ им. Н.Н. Блохина Минздрава России, объектом исследования была ДНК, выделенная из крови пациентов методом ПЦР с помощью электрофореза и ПЦР-секвенированием аберрантного участка.
Результаты исследования и обсуждение
Для того чтобы приблизиться к пониманию биологических закономерностей проявления ПМЗН, необходимо изучить как семейные, так и клинические ассоциации различных форм опухолей. За последние 20 лет в ФГБУ РОНЦ им. Н.Н. Блохина Минздрава России ПМЗН органов женской репродуктивной системы были выявлены у 635 больных. При этом злокачественные новообразования яичников чаще всего сочетались с опухолями молочной железы – в 102 (38,63%) наблюдениях, тела матки – в 79 (30,0%) наблюдениях и толстой кишки – в 27 (10,09%) наблюдениях. Таким образом, было установлено, что в подавляющем большинстве случаев при полинеоплазии у женщин отмечается совместное проявление таких форм опухолей, как злокачественные новообразования яичников, тела матки, молочной железы и толстой кишки. При анализе семейного анамнеза этих больных было установлено, что однотипные локализации опухолей в этих семьях были выявлены в 20% наблюдений, а 16% их родственников страдали полинеоплазией. Из 2318 родственников 1-й степени родства больных полинеоплазией у 19 (0,8%) была выявлена более чем одна первичная опухоль, что значительно превышает популяционную частоту ПМЗН г. Москвы и Московской области (0,008%). Таким образом, необходимо отметить, что выявленные в процессе нашего исследования случаи ПМЗН можно считать наследственно обусловленными, так как вероятность случайного накопления аналогичных поражений в семьях при такой низкой популяционной частоте чрезвычайно мала.
Самой частой разновидностью семейных опухолевых заболеваний у женщин является наследственный рак молочной железы. Его вклад в общую встречаемость рака молочной железы составляет примерно 5–10% [3, 4]. «Классические» разновидности наследственного рака молочной железы ассоциированы также с высоким риском развития рака яичников, поэтому в медицинской литературе обычно используется термин «синдром рака молочной железы/рака яичников» (breast-ovarian cancer syndrome). Доля наследственного рака молочной железы/рака яичников в общей заболеваемости рака яичников еще более заметна. Считается, что как минимум 10–15% случаев рака яичников можно объяснить присутствием генетического фактора [5].
Однако наиболее объективную информацию для формирования групп повышенного риска развития злокачественных новообразований дает ДНК-диагностика. Одним из значительных достижений молекулярно-генетических исследований было открытие генов BRCA1 и BRCA2, выявление мутаций которых на сегодняшний день стало уже рутинным.
В нашем исследовании 520 женщин, которым определялась частота встречаемости восьми мутаций в генах BRCA1/2 и CHEK2, по количеству первичных опухолей были поделены на четыре группы: больные солитарным раком яичника (n=79); больные ПМЗН с поражением яичников (n=26); больные солитарным раком молочной железы (n=410); больные ПМЗН обеих молочных желез (n=5).
У пациенток с диагнозом «солитарный рак яичников» мутации в гене BRCA1обнаружено в 8 (10,13%) наблюдениях, из них один случай с мутацией 185delAG (1,47%) и семь с мутацией 5382insC (8,66%). При этом средний возраст больных раком яичников, не являющихся носителями мутаций, составил 61,2±10,9 года, а средний возраст пациенток-носителей мутаций был значительно ниже и составил 52,5±10,1 года (р<0,01) (табл. 1).
В группе больных ПМЗН с поражением яичников мутации в гене BRCA1 были выявлены в 18 (54,55%) наблюдениях, из них 2 случая с мутацией 185delAG (6,06%), 5 случаев с мутацией 300Т>G (15,15%), два – с мутацией 4153delA (6,06%) и 9 случаев с мутацией 5382insC (27,28%). Средний возраст пациенток – не носителей мутаций составил 57,6±13,7 года, что значительно превышает средний возраст больных полинеоплазией носителей мутаций (их средний возраст составил 43,0±5,8 года).
У больных солитарным раком молочной железы частота 4 исследуемых мутаций в гене BRCA1 составила 5,1% (n=21), а в гене BRCA2 – 0,5% (n=2), что не противоречат популяционным частотам мутаций в этих генах в европейских странах [1]. При этом наследственный рак молочной железы в основном ассоциируется с мутацией 5382insC гена BRCA1 (табл. 2).
При диагностике мутаций в генах BRCA1/2 из 5 больных ПМЗН обеих молочных желез только в одном наблюдении была обнаружена мутация 6174delT в гене BRCA2. В 4 наблюдениях была выявлена мутация 5382insC гена BRCA1.
Следует отметить, что в изучаемых нами группах мутациии1100delC в гене CHEK2 обнаружено не было. Можно предположить, что данная мутация не ассоциирована с риском развития рака яичников, однако для подтверждения этого факта необходимы дальнейшие исследования. Что касается мутаций в гене BRCA2, то это соответствует полученным ранее данным о частоте подобных мутаций при раке яичников в других популяциях. В отличие от BRCA1 мутации гена BRCA2 могут носить соматический характер и выявляться на поздних стадиях спорадического рака яичников [6].
Синдром Линча. Кроме того, у больных ПМЗН репродуктивной системы часто встречается синдромом наследственного неполипозного колоректального рака (ННКРР), или синдром Линча [2]. Главным признаком этого синдрома является развитие в молодом возрасте опухолей толстой кишки и/или злокачественных опухолей эндометрия и/или яичников. До выявления генов, ассоциированных с этим синдромом, предрасположенность к нему устанавливали на основании клинических признаков и семейного генетического анамнеза. В связи с чем для этого синдрома были разработаны специфические так называемые Амстердамские критерии (Х.Ф. Васен, 1999 г.) [2], которые подразумевают:
- наличие в семье трех и более родственников, пораженных раком толстой кишки, один из которых – родственник первой степени родства;
- последовательное поражение раком толстой кишки родственников в двух поколениях;
- один и более случай рака толстой кишки, диагностированный у родственников в возрасте до 50 лет;
- отсутствие полипоза в каждом случае рака толстой кишки.
Еще раз отметим, что достоверную информацию для определения групп высокого риска развития ПМЗН несет ДНК-диагностика. Известно, что причинами возникновения синдрома Линча являются гены системы репарации неспаренных оснований ДНК (mismatch repair): MLH1, MLH3, MSH2, MSH6, PMS1, PMS2 [2]. Основная их функция заключается в исправлении ошибок репликации ДНК и неточности репарации двунитевых разрывов. Нарушение работы генов MSH2, MLH1, MSH3 и/или PMS2 связано с мутационными изменениями в протоонкогенах и генах супрессорах опухоли, приводящими к возникновению опухолей [2].
Изучая данные международных исследований, хочется обратить внимание, что мутация любого из генов системы репарации резко увеличивает риск возникновения рака яичников – до 10%, рака эндометрия – до 71%, рака толстой кишки у женщин – до 85% [7].
В работе определялась частота встречаемости трех ключевых генов системы репарации неспаренных оснований ДНК (mismatch repair): MLH1, MSH2, MSH, у больных с синдромом Линча. Анализируя уже имеющиеся в канцер-регистре ФГБУ РОНЦ им. Н.Н. Блохина Минздрава России данные, установлено, что в группе больных ПМЗН органов репродуктивной системы и толстой кишки мутации в генах системы репарации неспаренных оснований ДНК были выявлены в 13 (37%) наблюдений. У больных ПМЗН эндометрия и толстой кишки чаще всего выявлялась мутация в гене MSH6.
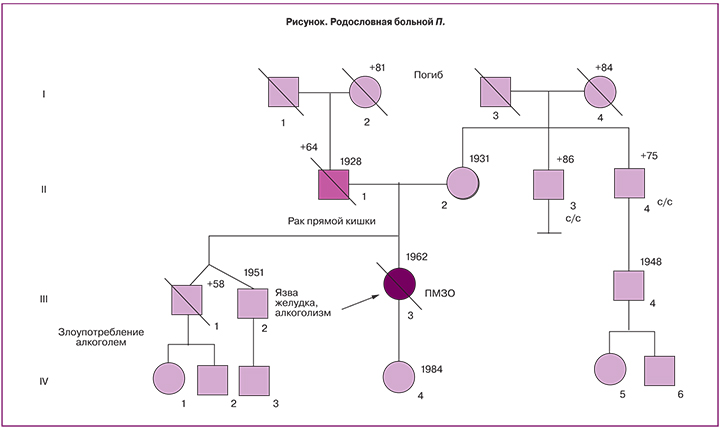
В качестве клинического примера приведем родословную больной П. (рисунок).
Как следует из родословной, отец (II-1) перенес операцию по поводу рака прямой кишки (в институте проктологии), умер от прогрессирования заболевания (метастазов в легких) в возрасте 64 лет. Поражение пробанда (пациентки) метахронным первично-множественным раком эндометрия в 50 лет и слепой кишки в 53 года и наличие в семье заболевания раком прямой кишки у отца пробанда соответствуют наследственному варианту заболевания раком – синдрому ННКРР. Пациентке предложено провести ДНК-диагностику мутаций в генах MLH1, MSH2, MSH6. При исследовании ДНК, выделенной из крови пробанда, в гене MSH2 обнаружена мутация c.1170 delT (p.Leu390Leufs*21). Выявленное носительство герминальной мутации в гене MSH2 подтверждает наследственный вариант рака толстой кишки. Таким образом, для пробанда риск развития рака толстой кишки в течение жизни составляет 85%, 2/3 из которого поражает правую половину толстой кишки. Риск развития рака желудка, тонкой кишки, поджелудочной железы, мочевыводящей системы составляет от 30 до 60%. Возможно также развитие аденом толстой кишки, кератоакантом и эпителиом кожи. Поскольку синдром ННКРР имеет доминантный тип наследования, риск развития рака толстой кишки для дочери (из родословной IV-4), для брата и его детей (III-2, IV-1,2,3) составляет 50%. Для диагностики возможного носительства обнаруженной мутации для этих членов семьи рекомендовано прямое молекулярно-генетическое тестирование гена MSH2.
Заключение
Таким образом, взаимосвязь и взаимообусловленность проявления первых и вторых первичных опухолей при полинеоплазии определяется генетическими факторами, которые объясняют частое совместное наследование и проявление при ПМЗН у женщин таких форм опухолей, как рак молочной железы, толстой кишки, яичников и эндометрия, что предполагает сходный механизм канцерогенеза. Последние данные представляют для клиницистов особый интерес, поскольку если у больного ПМЗН одна из первичных опухолей соответствует указанным выше локализациям, то можно ожидать появления в отдельно взятых семьях аналогичных солитарных опухолей у родственников. И наоборот, при накоплении злокачественных опухолей однотипных локализаций у родственников высока вероятность проявления в семьях первично-множественного поражения. Своевременная идентификация этих генетических нарушений позволяет разрабатывать наиболее эффективную стратегию для лечения уже протекающего заболевания и осуществлять профилактику других злокачественных новообразований, что особенно важно не столько для самих больных, сколько прежде всего для их родственников, у которых еще не возникла опухолевая патология.



