Инфекции мочевыводящих путей (ИМП) – термин, охватывающий инфекционно-воспалительные заболевания любого органа мочевыводящей системы, при которых имеется микробная колонизация мочи (бактериурия). Современная классификация Европейской ассоциации урологов (EAU, 2000) подразделяет ИМП на неосложненные и осложненные и, как правило, наиболее часто в практике встречаются неосложненные ИМП [1, 2].
ИМП нередко осложняют течение беременности, причем риск развития ИМП у беременных женщин значительно выше, чем у небеременных. В структуре ИМП беременных помимо острого цистита и пиелонефрита выделяют бессимптомную бактериурию, которая при отсутствии адекватной терапии в 30% случаев может переходить в симптоматические ИМП [3].
Традиционно степень бактериурии в диагностике ИМП определяется на основании оценки концентрации бактерий, что позволяет дифференцировать истинную бактериурию от контаминации. Однако все же имеются некоторые разногласия, касающиеся определения ИМП и ее диагностики, и до сих пор противоречивыми остаются мнения по поводу значимости низкой и бессимптомной бактериурии в развитии ИМП [4].
По одним данным, диагностический титр первичных возбудителей ИМП (E. coli), обнаруженных в собранной при естественном мочеиспускании пробе мочи, должен быть не менее 103 КОЕ/мл, а по другим – ≥104 КОЕ/мл для женщин и ≥103 КОЕ/мл для мужчин. Некоторые авторы считают, что при наличии характерных для цистита симптомов и обнаружении при культуральном исследовании средней порции утренней мочи микроорганизмов в 102–104 КОЕ/мл бактериурия должна считаться клинически значимой и являться показанием к антибактериальной терапии [1–3, 5, 6]. В современных клинических руководствах в качестве диагностического критерия рекомендуется ввести понятие low-cоunt bacteriuria (бактериурия низкой степени), то есть 103–105 КОЕ/мл. При этом необходимо учитывать наличие клинических симптомов у пациента, способ получения пробы мочи и метод определения титра бактерий, а также их патогенные свойства [7–9].
Для выявления бактериурии, наряду с микроскопией осадка мочи, применяют различные методы быстрой диагностики, так называемые скрининг-тесты: тест восстановления трифенилтетразолия хлорида (ТТХ-тест), тест на определение эстеразы лейкоцитов, dipstick test и др. Следует отметить , что чувствительность скрининг-тестов для диагностики бактериурии невысокая, поэтому подтверждать их необходимо культуральным исследованием. Посев мочи на сегодняшний день считается «золотым стандартом», так как является наиболее информативным способом диагностики бактериурии, позволяющим определить количественную характеристику этиологического агента. Однако на выполнение данного исследования требуется от 36 до 72 часов, а учитывая, что почти в 70% случаев при посеве мочи мы получаем отрицательный результат, столь дорогостоящее исследование может оказаться необоснованным [1, 10, 11].
С начала XXI столетия в бактериологических лабораториях Европы и России для диагностики бактериурии стали использовать сразу два принципиально новых метода быстрого выявления и идентификации бактерий в моче – проточную цитофлюометрию и времяпролетную масс-спектрометрию [11–15].
Проточная цитофлюометрия – технология полупроводникового диодного лазера, позволяющая идентифицировать и подсчитывать флюоресцентно-меченные частицы в жидких средах. На этом принципе работает автоматический анализатор осадка мочи UF-500i (1000i) (Sysmex corp., Япония) и определяет такие показатели, как эритроциты, лейкоциты, эпителиальные клетки, цилиндры, кристаллы, бактерии с приблизительным разделением на грамотрицательные, грамположительные и грибы.
Масс-спектрометрия (MS) – аналитический метод измерения массы заряженных частиц (атомов, молекул) анализируемого вещества по их поведению в электрических и/или магнитных полях (молекулярные весы). Масс-спектрометр – это инструмент, способный определять массы неорганических и органических молекул, в том числе белков, нуклеиновых кислот, липидов, являющихся компонентами животных и бактериальных клеток.
Таким образом, целью нашего исследования стало определение эффективности современных методов диагностики бактериурии (масс-спектрометрии, проточной цитофлюориметрии) путем параллельного сравнительного исследования и выбор наиболее оптимального способа диагностики ИМП.
Материал и методы исследования
Работа проводилась с августа 2011 г. по апрель 2013 г. на базе лаборатории микробиологии ФГБУ Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова Минздрава России. Был проведен комплексный анализ 790 клинических образцов мочи, полученных от пациентов мужского и женского пола разных возрастных групп (включая беременных женщин и новорожденных детей), находившихся на стационарном или амбулаторном лечении Центра. Исследование проводилось параллельно 3 методами:
Методом флуоресцентной проточной цитометрии, на автоматическом бактериологическом анализаторе UF-500i (Sysmex corp., Япония) в ручном режиме измеряли содержание лейкоцитов и бактериальных клеток в образцах мочи.
Методом прямого белкового профилирования осадка мочи c помощью MALDI-TOF масс-cпектрометра Autoflex III (Bruker Daltoniсs, Германия).
Классическим культуральным методом, путем посева на питательные среды с последующей идентификацией и определением чувствительности к антимикробным препаратам на Vitek2Compact (BioMerieux, Франция).
Культуральное исследование мочи применяли в качестве референсного метода. Посев мочи производили на 5% кровяной агар и среду Сабуро. Количественный посев и учет результатов проводили по международной методике количественного бактериологического исследования мочи Clinical Microbiology Procedures [16]. Идентификацию выделенных микроорганизмов проводили двумя методами: по биохимическим показателям при помощи автоматического бактериологического анализатора Vitek2Compact и масс-спектрометрическим анализом на приборе AutoflexIII.
Оценка результатов:
1. При визуальном отсутствии роста колоний на питательной среде для образцов, полученных при свободном мочеиспускании, микробное число оценивали как <102 КОЕ/мл.
2. При положительном результате количество выросших микроорганизмов оценивали следующим образом: 1 колония соответствует 102 КОЕ/мл; 10 колоний соответствуют 103 КОЕ/мл; 100 колоний соответствуют 104 КОЕ/мл; при сливном росте оценивали как 105 КОЕ/мл и выше.
Степень бактериурии, не превышающая 103 КОЕ/мл, как правило, свидетельствовала об отсутствии воспалительного процесса и являлась результатом «контаминации» (за исключением случаев с наличием клинических симптомов цистита и лейкоцитурии, при повторном выделении микроорганизма из мочи после антибактериальной терапии, а также у новорожденных детей). При степени бактериурии 104 КОЕ/мл оценивали наличие клинических симптомов и лейкоцитарной реакции. Наличие истинной бактериурии считали при росте микроорганизмов в титре 105 КОЕ/мл и выше.
Все полученные результаты были разделены на три группы:
Положительные «+» по всем трем методам:
Наличие роста микроорганизмов в титре ≥104 КОЕ/мл (идентификация выделенной культуры на Vitec2Сompact и MALDI-TOF MS).
Прямая идентификация микроорганизма из осадка мочи на масс-спектрометре (score ≥ 1,7), совпадающая с идентификацией культуральным методом.
Титр бактерий по данным UF-500i BACT ≥104 КОЕ/мл и наличие лейкоцитов более 10 в мкл.
Отрицательные «–» по всем трем методам:
Отсутствие роста микроорганизмов на питательных средах.
Не идентифицировано на масс-спектрометре.
Титр бактерий по данным UF-500i BACT <104 КОЕ/мл и количество лейкоцитов менее 10 в мкл.
Пробы, где не совпадали результаты по различным методам.
Результаты исследования и обсуждение
Результаты комплексного анализа 790 образцов показали, что:
- отрицательными «–» всеми тремя методами оказались 422 образца, что составило 53,4%;
- положительными «+» всеми тремя методами оказались 96 образцов (12,2%);
- в 272 образцах мочи (34,4%) имелись расхождения.
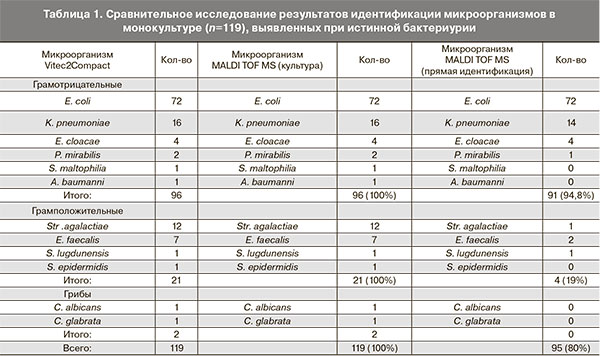
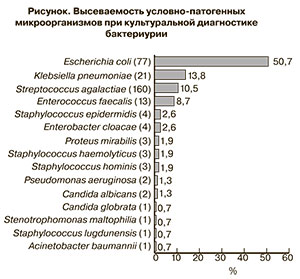
По результатам посева мочи в 249 образцах был отмечен рост микроорганизмов в различных титрах. Истинная бактериурия (титр ≥105 КОЕ/мл) была установлена в 136 случаях (54,6%) и было выделено при этом 152 культуры микроорганизмов: 109 – грамотрицательные, 40 – грамположительные и 3 культуры грибов рода Candida (рисунок). В 17 пробах был обнаружен рост двух видов бактерий в высоких титрах одного из них.
При сравнении образцов с положительным ростом культур в титре ≥105 КОЕ/мл (n=136) с анализом на UF-500i результаты полностью соответствовали показателю посева. При анализе лейкоцитарной реакции в 56 случаях уровень лейкоцитов не превышал L<10/мкл, что свидетельствовало, возможно, о бессимптомной бактериурии, а в 80 случаях значение лейкоцитов было повышено (L≥10/мкл), что подтверждало наличие инфекции.
Параллельная идентификация всех выделенных при посеве культур двумя методами (биохимическим и масс-спектрометрией) была получена со 100% совпадением результатов как на уровне рода, так и вида микроорганизма.
При масс-спектрометрической идентификации микроорганизмов непосредственно в клиническом материале среди 136 образцов с истинной бактериурией (титр ≥ 105 КОЕ/мл) в 97 случаях (71,3%) результаты прямой идентификации совпадали. В 39 случаях (28,7%) метод MALDI-TOF MS не обеспечивал надежной идентификации, из них в 24 образцах с монокультурой и в 16 со смешанными культурами (табл. 1).
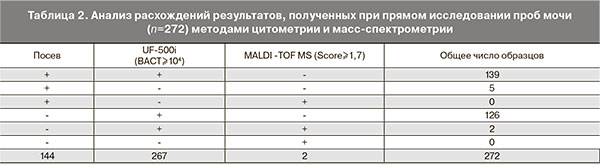
Сравнительный анализ результатов 272 проб, где были получены расхождения, показал, что в 267 случаях были отмечены повышенные показатели бактерий на UF-500i (BACT ≥ 104 КОЕ/мл), а наличие роста культур в различных титрах было в 144 случаях (табл. 2).
Мы провели сравнительный анализ 267 положительных образцов мочи на наличие бактерий на UF-500i (BACT≥104 КОЕ/мл) с результатами культуральных исследований.
В 144 образцах был получен рост микроорганизмов в различных титрах. При этом значение бактерий на UF-500i указывало на наличие бактериурии (BACT≥104 КОЕ/мл) в 139 случаях (96,5%). Из них в 76 случаях степень бактериурии совпадала с титрами микроорганизмов при посеве (как при концентрации выше 105 КОЕ/мл, так и при низкой концентрации микробов в моче), а в 63 случаях титр BACT на UF-500i оказался выше на 1–2 порядка, чем в посеве. В 5 случаях (3,5%) значение BACT указывало на отсутствие бактерий, рост культуры при этом был в титре ниже 103 КОЕ/мл.
 В 126 образцах отсутствовал рост микроорганизмов, тогда как значение бактерий на UF-500i указывало на наличие бактериурии (BACT≥104 КОЕ/мл).
В 126 образцах отсутствовал рост микроорганизмов, тогда как значение бактерий на UF-500i указывало на наличие бактериурии (BACT≥104 КОЕ/мл).
В 91 образце значение лейкоцитов было в норме (L<10/мкл). При анализе лейкоцитарной реакции в 35 образцах значение было завышенным (L≥10/мкл).
При сравнении результатов анализов 272 образцов, где были получены расхождения, видно, что лишь в двух случаях результат на MALDI-TOF MS был положительным. При отрицательном посеве были получены с высокой степенью достоверности идентификации на MALDI-TOF MS E. сoli (score 2,2) и St. epidermidis (score 2,0) с положительным показателем BACT на UF-500i (BACT≥108 и BACT≥106 соответственно). Из 144 положительных при культуральном посеве образцов в титре как выше 104 КОЕ/мл, так и ниже ни в одном случае не было получено положительной идентификации.
Использование анализаторов, способных в кратчайшие сроки распознать бактериурию, неуклонно растет, и такие устройства, как UF-500i (1000i) сейчас являются необходимым ресурсом лабораторий в крупных лечебно-диагностических центрах. Специфичность этих приборов, как правило, невысока, однако пробы с отсутствием бактерий и лейкоцитов могут быть исключены из дальнейшего анализа, что позволит значительно сэкономить ресурсы лаборатории.
Ранее проведенные исследования показывают неоднозначные результаты применения проточных цитофлюориметров UF-500i (1000i) для диагностики бактериурии. К примеру, по результатам применения UF-1000i на 181 образце мочи Н.А. Маянским с соавт. продемонстрирована целесообразность включения данной методики в процесс скрининга бактериурии [17], тогда как исследования Maarten A.C. Broeren на 1577 образцах не гарантируют правильность результатов UF-1000i при использовании его в качестве скринингового анализатора [14]. В исследовании Jie Wang и соавт. 313 образцов мочи при скрининге на UF-1000i показали достаточно высокую чувствительность (97%) и специфичность (79%). Прогностическая ценность отрицательного результата составила 99%, а точность 85%. Также была получена положительная прогностическая стоимость (70%) метода. Прогностическая ценность отрицательного результата оставалась высокой даже в случаях сложных образцов [13].
В нашем исследовании из 790 образцов в 657 случаях (83,2%) показатели наличия или отсутствия бактериурии на UF-500i совпадали с результатами посевов. При этом из 249 положительных посевов в 171 образце (68,7%) титр микроорганизмов совпадал обоими методами и в 73 (9,3%) значение BACT превышало на 1-2 порядка. Отчасти такой результат может быть связан со сниженной жизнеспособностью бактерий или наличием мертвых бактериальных клеток в анализируемых образцах, например, на фоне проводимой антибактериальной терапии.
В 16,2% отмечено наличие бактериурии на UF-500i (BACT≥104 КОЕ/мл) при полном отсутствии роста микроорганизмов в посевах. При этом в 37 случаях были отмечены высокие показатели лейкоцитов (L≥10/мкл), где также, вероятнее всего, можно думать о недавно проведенной антибактериальной терапии. В 91 случае наличие бактериурии на скрининге сопровождалось нормальным уровнем лейкоцитов, что свидетельствует о несколько завышенной чувствительности используемого анализатора.
В 5 из 790 проб (0,6%) значение BACT на UF-500i указывало на отсутствие бактерий, однако результаты посевов были положительными. При анализе роста культур был отмечен низкий титр бактерий (ниже 103 КОЕ/мл), а уровень лейкоцитов в этих случаях соответствовал норме (L<10/мкл), что было расценено нами как «контаминация».
Таким образом, в подавляющем большинстве (83,2%) случаев можно было с высокой точностью ориентироваться на показатели UF-500i, особенно в случаях с высокими титрами бактерий, либо при их отсутствии в сочетании с отсутствием лейкоцитов.
Мировой опыт применения метода MALDI-TOF MS для идентификации бактерий из выделенных культур подтверждают высокую ценность данного метода и открывают все новые ресурсы для его внедрения в различные схемы микробиологической диагностики инфекций. Результаты нашего исследования показали полное совпадение результатов как на родовом, так и видовом уровне идентификации всех выделенных при посеве культур двумя методами (биохимическим и масс-спектрометрией), и тем самым подтвердили значимость метода MALDI-TOF MS в вопросе решения задач по развитию методов быстрой микробиологии.
Серьезной проблемой в получении положительных результатов методом MALDI-TOF MS непосредственно из клинических образцов является титр бактерий. Результаты, полученные с клиническими образцами, при титре менее 105 КОЕ/мл были значительно хуже, чем в пробах с высоким титром. Пробы с титром 104 КОЕ/мл и ниже не прошли идентификацию на масс-спектрометре. Впрочем, титр 104 КОЕ/мл является диагностическим порогом для ИМП и в некоторых случаях целый ряд традиционных культур с низким количеством бактерий будет также отмечен как отрицательный, в зависимости от категории пациента и наличия у него клинических проявлений ИМП.
Огромным преимуществом метода MALDI-TOF MS является возможность быстрой и высокоточной идентификации этиологического агента, однако без возможности определения его чувствительности к антимикробным препаратам, что диктует необходимость использования традиционных методов. Применение метода MALDI-TOF MS для определения чувствительности, а именно маркеров резистентности, на сегодняшний день описано лишь в единичных работах некоторых исследователей, которые пока не достигли возможности использовать этот метод в рутинной практике [28].
Выводы
Культуральное исследование мочи остается «золотым стандартом» в диагностике ИМП. Использование MALDI-TOF MS позволяет быстро проводить видовую идентификацию выделенных культур, что сокращает время исследования на 24 часа.
При наличии истинной бактериурии MALDI-TOF MS позволяет быстро идентифицировать напрямую в моче микроорганизмы в высоких титрах, что сокращает время до начала этиотропной терапии.
По анализу мочи на проточном цитофлуориметре можно с определенной вероятностью предполагать наличие бактериурии при концентрации бактерий >105 КОЕ/мл, либо ее отсутствие при отрицательном результате и отсутствии лейкоцитов. В условиях крупного стационара и большого количества проб мочи с помощью анализатора UF-500i возможно проведение скрининга в целях уменьшения проб для бактериологического исследования.
Данные методы можно использовать как вспомогательные для быстрой диагностики бактериурии, не отменяя классического культурального исследования.