Хронический эндометрит (ХЭ) характеризуется локальным воспалением слизистой оболочки матки инфекционной природы, инфильтрацией плазмоцитами стромы эндометрия и распространенностью в общей популяции от 14,1 до 24,4% [1, 2]. Исследования, проведенные за последнее десятилетие, выявили потенциальную связь между ХЭ и неудачными репродуктивными исходами. Так, ХЭ обнаруживается у женщин с бесплодием неясной этиологии с частотой 2,8–56,8%, с привычным невынашиванием беременности (ПНБ) – в 9,3–68,3% наблюдений, при повторных неудачах имплантации (ПНИ) – в 7,7–67,5% случаев [3–7]. У пациенток с ХЭ существенно ниже, по сравнению с женщинами без ХЭ, частота наступления беременности (30,8% против 63,0%) и живорождений (7,7% против 51,9% соответственно) [8]. McQueen D.B. et al. также отмечают меньшую частоту живорождений у пациенток с ПНБ (67,6% против 87,1% соответственно) [9]. Нарушения репродуктивной функции при ХЭ исследователи связывают с лейкоцитарной инфильтрацией и изменением рецептивности эндометрия в результате активации местной секреции цитокинов и хемокинов, нарушением децидуализации и васкуляризации эндометрия, измененной сократительной активностью матки [10].
В литературе отмечаются различные подходы к лечению ХЭ. За рубежом широко обсуждается антибактериальная (АБ) терапия заболевания, тогда как отечественные исследователи предлагают двухэтапный подход с проведением элиминации условно-патогенных и патогенных микроорганизмов, а также снижением активности вирусов на первом этапе с последующим восстановлением морфофункционального потенциала эндометрия, гемодинамики и активности рецепторного аппарата – на втором [11, 12].
На сегодняшний день получены сведения об эффективности АБ-терапии ХЭ высокой степени доказательности. Систематический обзор и метаанализ (12 рандомизированных контролируемых испытаний (РКИ)) показали излечение ХЭ с помощью АБ в 87,9% наблюдений с показателем живорождения 62,4% [13]; метаанализ исходов ЭКО (10 РКИ) продемонстрировал увеличение частоты живорождений в 5 раз, что было сопоставимо с женщинами без ХЭ [14], а метаанализ (12 РКИ) убедительно показал, что у пациенток с излеченным ХЭ показатели частоты клинической беременности и коэффициента рождаемости были существенно выше по сравнению с пациентками с персистирующим ХЭ (отношение шансов (ОШ) 9,75 и 6,82 соответственно) [11].
В настоящее время исследования, изучающие возможность улучшения репродуктивных исходов у пациенток с ХЭ, во всем мире направлены на оценку взаимодействия микробиоты эндометрия с иммунной системой и активации иммунопатологических процессов как причины нарушений имплантации. Аутоиммунная природа ХЭ не находит подтверждения в современных исследованиях [15]. Напротив, обнаружено, что в эндометрии присутствуют иммунокомпетентные клетки (лимфоциты, Т-клетки хелперы и другие), которые секретируют цитокины, представляющие собой пептидные информационные молекулы, которые способствуют миграции макрофагов и натуральных киллеров (NK-клеток) из периферической крови к эндометрию. Повышенная секреция провоспалительных цитокинов Т-хелперами (Th) 1, вероятно, оказывает негативное влияние на имплантацию и инвазию клеток трофобласта. Преобладающая популяция Th2 (противовоспалительных) и Т-регуляторных (Treg) клеток, наоборот, способствует лучшему исходу беременности [16, 17]. Присутствие вирусов также вносит серьезные изменения в иммунный статус. Отмечаются увеличение числа цитотоксических NK-клеток, направленных на уничтожение клеток, пораженных вирусами, и активация клеток, экспрессирующих CD16+ (рецептор к иммуноглобулину G), продуцирующих цитокины и цитотоксические факторы к клеткам эндометрия и трофобласта, что создает условия, неблагоприятные для имплантации, и может препятствовать наступлению беременности или способствовать раннему выкидышу [18].
Нарушения функции иммунной системы и иммунных механизмов толерантности матери к полуаллогенному плоду считаются потенциально модифицируемыми причинами бесплодия, ПНИ и ПНБ [19]. Применение иммуномодулирующих средств в попытке добиться успешной беременности при данных состояниях рассматривается учеными как перспективное направление и активно изучается. Авторы систематического обзора и метаанализа 53 исследований, в которых применялись средства специфической иммуномодулирующей терапии, выполненного в 2022 г., пришли к заключению, что для некоторых подгрупп пациентов с бесплодием, ПНИ и ПНБ их использование может быть полезным [20]. Эффективность ряда иммуномодулирующих средств, используемых за рубежом, была оценена в сетевом метаанализе 16 РКИ среди пациенток с ПНИ. Эффективность была наилучшей при внутриматочном введении мононуклеарных клеток периферической крови (МПКП) в отношении живорождения (OШ=2,35) и аутологичной богатой тромбоцитами плазмы – в отношении частоты имплантации (ОШ=2,81) по сравнению с другими средствами [21]. Другой сетевой метаанализ 21 РКИ продемонстрировал схожие оценки в повышении живорождения для МПКП (отношение рисков (ОР)=2,96), а также для препарата рапамицин (ОР=3,55) по сравнению с плацебо [22].
В 46 отечественных публикациях, найденных на сайте eLIBRARY.RU за 2018–2023 гг. по ключевым словам «хронический эндометрит», «иммуномодулирующая терапия», «цитокины», обсуждаются вопросы взаимосвязи воспалительных и иммунологических изменений при ХЭ, повышения эффективности лечения; из них 8 статей посвящены изучению эффективности комплекса экзогенных природных противомикробных пептидов и цитокинов, являющегося средством, получаемым из мононуклеарных клеток периферической крови (лейкоцитов крови свиней). В исследованиях показано его положительное влияние на элиминацию возбудителей, частоту разрешения ХЭ, экспрессию определенных генов и частоту наступления беременности [23–25]. Однако оценка проведенного лечения по конечным результатам (течение беременности, ее исходы, частота живорождения, состояние новорожденного) проведена только в одной работе небольшой мощности (76 пациенток) [26].
Результаты вышеуказанных зарубежных и отечественных исследований свидетельствуют о необходимости дальнейшего изучения данной проблемы и проведения качественных РКИ для получения доказательств высокого уровня.
Цель исследования: повысить эффективность комплексного лечения в прегравидарном периоде пациенток с ХЭ и нарушением репродуктивной функции с использованием комплекса экзогенных природных противомикробных пептидов и цитокинов и оценить его влияние на частоту наступления беременностей, их течение и исходы.
Материалы и методы
Дизайн. Проспективное открытое РКИ в параллельных группах. Дизайн был открытым для участников и клиницистов, слепым – для статистика и специалиста, проводившего анализ полученных данных, которые не были связаны с ведением пациенток, участвующих в исследовании, для создания условий независимой оценки результатов.
Организация исследования. Набор материала и наблюдение проводились с сентября 2019 по февраль 2023 гг. на базе женской консультации ГБУЗ ТО «Перинатальный центр» (Тюмень, Россия). Окончательные сведения о живорождениях были доступны в феврале 2023 г. Протокол исследования подготовлен с учетом положений Хельсинкской декларации Всемирной Медицинской Ассоциации (пересмотр 64-й Генеральной ассамблеи WMA, г. Форталеза, Бразилия, 2013 г.), документа «Международные этические рекомендации по проведению биомедицинских исследований с участием людей» (International Ethical Guidelines for Biomedical Research Involving Human Subjects) Совета международной организации медицинских наук (ред. 2002 г.), Национального стандарта РФ ГОСТ Р52379-2005 «Надлежащая клиническая практика» (2005 г.), других законодательных и нормативных документов РФ. Все пациентки подписали информированное добровольное согласие на участие в исследовании после предоставления им устных и письменных объяснений относительно исследования.
Исследование получило название ТЮЛЬПАН (аббревиатура от: ТЮменский перинатаЛЬный центр, течение и исходы беременности у ПАциенток с хроническим эНдометритом).
Исследование получило положительное заключение локального Комитета по этике (окончательная версия протокола v3.0 от 20 июля 2019 г.).
Контингент. Оценены на приемлемость участия в исследовании 4153 пациенток с бесплодием, обусловленным ХЭ. Набор пациенток осуществлялся из числа женщин, обратившихся в женскую консультацию Тюменского перинатального центра с жалобами на отсутствие беременностей в течение 1–10 лет, которые до включения в настоящее исследование прошли обследование с целью установления причины бесплодия (рисунок).
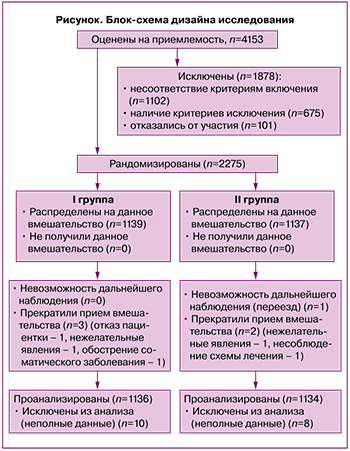
Расчет выборки не требовался, так как в исследование были включены все пациентки, обратившиеся за медицинской помощью и отвечавшие критериям включения, за указанный период.
Критерии включения: возраст 18–45 лет; наличие маточной формы бесплодия (N97.2 Женское бесплодие маточного происхождения, дефект имплантации яйцеклетки) с гистологически и иммуногистохимически подтвержденным диагнозом ХЭ (N71.1 Хроническая воспалительная болезнь матки); наличие вирусовыделения (вирусы группы герпеса, папилломы человека); проходимые маточные трубы; отсутствие гипоплазии эндометрия (М-эхо более 8 мм в первой фазе менструального цикла); овуляторный менструальный цикл; изокоагуляция крови; отсутствие противопоказаний к применяемым лекарственным средствам; информированное согласие пациентки.
Критерии исключения: мужской фактор бесплодия (тератозооспермия III–IV степени), гинекологические заболевания (миома матки, эндометриоз, кисты яичников, интраэпителиальные поражения шейки матки, в том числе в анамнезе), пороки развития, иные причины бесплодия, инфекции, передающиеся половым путем, и/или инфекционно-воспалительные заболевания нижнего отдела полового тракта в течение последних 6 месяцев; тяжелые соматические заболевания, резус-отрицательная кровь; повышенная индивидуальная чувствительность к компонентам применяемых лекарственных препаратов.
Рандомизация. Рандомизация выполнялась на 2 группы методом генерации случайной последовательности распределения с помощью таблицы случайных чисел с вероятностью попадания в группы, равной 50%, использовался метод сокрытия случайной последовательности с помощью конвертов. Пациентки I группы (n=1126) применяли АБ-терапию и комплекс экзогенных природных противомикробных пептидов и цитокинов; пациентки II группы (n=1126) получали только АБ-терапию. В группах были выделены по две равные подгруппы (также методом рандомизации): IА и IIА – получавшие в составе комплексной терапии гестагены и IБ и IIБ – не получавшие гестагены.
Методы лечения. АБ-терапия включала таблетки диспергируемые доксициклина моногидрат (Юнидокс Солютаб, «ЗиО-Здоровье», Россия) по 100 мг 2 раза в день в течение 10 дней; комбинированный препарат, содержащий неомицина сульфата 100 мг, тернидазола 200 мг, нистатина 100 000 ЕД и преднизолона метасульфобензоата натрия 3 мг (Тержинан, Laboratoires Bouchara-Recordati, Франция) по 1 таблетке во влагалище утром 10 дней; далее после АБ-лечения – пробиотик, содержащий лактобактерии не менее 1×107-8 КОЕ по 1 вагинальной капсуле утром в течение 10 дней.
Иммуномодулирующая терапия проводилась комплексом экзогенных природных противомикробных пептидов и цитокинов (МНН: белково-пептидный комплекс из лейкоцитов крови свиней – Суперлимф, ООО «Альтфарм», Россия) суппозитории по 25 ЕД 1 раз в день вагинально вечером в течение 20 дней.
Терапия гестагенами включала дидрогестерон (Дюфастон, Abbott Biologicals B.V., Нидерланды) по 1 таблетке 10 мг 1 раз в день 10 дней с 15-го по 24-й дни менструального цикла на протяжении 1–6 циклов (до наступления беременности).
Все лекарственные препараты использовали в соответствии с действующими инструкциями по медицинскому применению, опубликованными в Реестре лекарственных средств (https://www.rlsnet.ru/).
Беременность планировалась после завершения лечения и процедур контрольного обследования в следующем цикле на фоне продолжающейся терапии дидрогестероном во вторую фазу цикла.
Гипотеза. Комплексное лечение пациенток с ХЭ и бесплодием, включающее Суперлимф, прогестерон и антибиотик, превосходит по своей эффективности только АБ-терапию в частоте наступления клинической беременности и живорождений.
Комплаенс и выбывание из исследования. Соблюдение пациентками режима приема лекарственных препаратов оценивалось путем «подсчета таблеток/суппозиториев», возвращенных участниками врачу-исследователю после окончания курса лечения. Соблюдение схемы лечения (комплаентность) определялось как прием более 80% исследуемых препаратов с даты распределения до окончания курса лечения.
Критерии выбывания: добровольный отказ пациентки от участия в исследовании, прием менее 80% исследуемых препаратов на курс, появление психотических симптомов, развитие одного из критериев невключения во время участия в исследовании, нарушение процедур протокола, развитие нежелательного явления, вызывающего неприемлемый риск для здоровья пациентки в случае продолжения ее участия в исследовании, возникновение или обострение сопутствующих соматических заболеваний, не связанных с приемом лекарственных препаратов, вызывающих необходимость в изменении процедур терапии и наблюдения, несовместимых с протоколом клинического исследования, беременность.
Методы обследования. Применялось комплексное обследование пациенток с использованием клинических, принятых в гинекологии, и лабораторных методов. Оценку проводили до включения пациенток в исследование и начала лечения. Методом опроса проводили сбор данных и оценивали социальные показатели, общий и гинекологический анамнез. Проводили визуализацию шейки матки в зеркалах и бимануальное гинекологическое исследование по общепринятой методике. Выполняли микроскопию мазков влагалищного содержимого (окраска по Граму, увеличение ×40 и ×100); использовали метод амплификации нуклеиновых кислот (полимеразная цепная реакция) в режиме реального времени для идентификации вирусов и исключения инфекций, передаваемых половым путем (Фемофлор, ООО «ДНК-технологии», Россия); морфологическое исследование аспиратов эндометрия (окраска гематоксилином и эозином, увеличение ×400), иммуногистохимическое исследование с окраской синдеканом-1 для определения плазмоцитов (CD138+) (ИФА набор Syndecan-1/CD138, CD138, SDC1) /Human Syndecan-1/CD138(SDC1) ELISA Kit; CUSABIO BIOTECH Co., Ltd., Китай). Положительной считали реакцию при визуализации одной плазматической клетки в 10 случайных полях зрения при увеличении ×400. Оценивалось наличие/отсутствие побочных эффектов (безопасность лечения) на основании дневников самонаблюдения.
Наблюдение. Пациентки находились под наблюдением в течение 6 месяцев после лечения для оценки частоты наступления беременности, затем – на протяжении беременности до родов для получения катамнестических сведений о первичных и вторичных результатах лечения и их сравнения между группами.
Оценка результатов. Первичные результаты – частота наступления клинической беременности в течение 6 месяцев после лечения (визуализация плодного яйца по данным ультразвукового исследования в сроке 6–8 недель) и частота живорождения (в срок 240–336 и 340 недель и более). Вторичные результаты – частота и гестационный срок выкидышей (до 236 недель), преждевременных (240–376 недель) и срочных родов (380–416 недель), особенности течения беременности (частота преэклампсии, преждевременной отслойки нормально расположенной плаценты, гипоксия и задержка роста плода, антенатальная гибель плода), состояние новорожденного (вес, оценка по Апгар на 1-й и 5-й минуте, неврологические нарушения). Оценивались также показатели нормализации микробиоценоза во влагалище и частота разрешения ХЭ по данным морфологического и иммуногистохимического исследований (критерий – отсутствие плазматических клеток) в следующем цикле после окончания лечения препаратом «Суперлимф». Регистрировались и анализировались нежелательные явления. Результаты регистрировались путем выкопировки сведений из индивидуальных карт беременной и родильницы (уч. форма № 111/у-20), медицинских карт беременной, роженицы и родильницы, получающей медицинскую помощь в стационарных условиях (№ 096/у-20), и историй развития новорожденных (№ 097-1/у-97).
Полученные результаты были анонимизированы и занесены в электронную базу данных. Анализ проводился после того, как все соответствующие результаты были введены и проверены как готовые к анализу. Сведения о пациентках с неполными данными были удалены. Количество пациенток в группах было уравнено. В окончательный анализ по основному критерию оценки (частота живорождений) были включены 2252 пациентки.
Статистический анализ
Статистический анализ полученных данных осуществляли при помощи пакета программ Statistica for Windows 10.0 (StatSoft Inc., США). Распределение признаков оценивали при помощи критерия Колмогорова–Смирнова. Нормально распределенные непрерывные переменные определялись как средние значения (М) со стандартными отклонениями (SD), в противном случае представлялись медианы (Ме) с межквартильными диапазонами (Q1; Q3). Для показателей, характеризующих качественные признаки, указывали абсолютное число (n) и относительную величину (%). Анализ различий в независимых выборках проводили с помощью U-критерия Манна–Уитни. Различия качественных признаков анализировали при помощи критерия χ2. При сравнении более двух групп использовали поправку Бонферрони. Принят уровень значимости р<0,05 при уровнях ошибки первого и второго рода: α=5% и β=20% соответственно. Анализ проводили в зависимости от назначенного вмешательства (intention-to-treat analysis). Взаимосвязь лечебного фактора и исхода оценивали по величине ОР с вычислением 95% ДИ по методу Woolf.
Результаты
Общие сведения о пациентках
Возраст пациенток варьировал от 18 до 45 лет, Ме=36 (33–38) лет. Социальная и клиническая характеристики пациенток представлены в таблице 1.
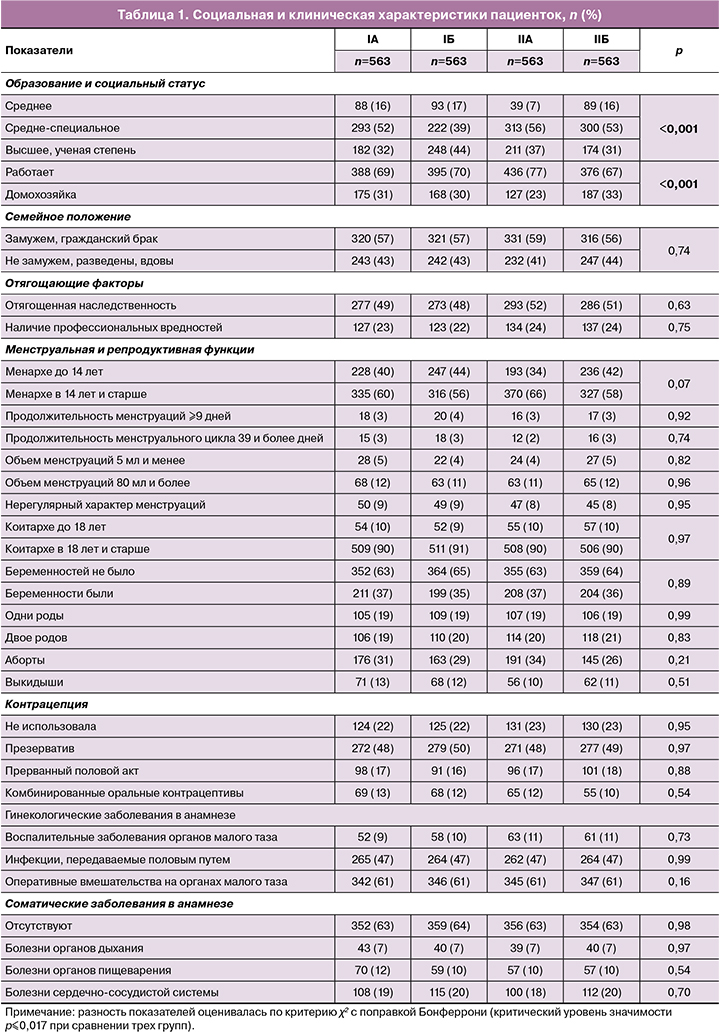
Анализ таблицы 1 показал различия пациенток между группами I и II по уровню образования и статусу работающих, по остальным параметрам – отсутствие статистически значимых различий. Индивидуальные показатели физикального осмотра по органам и системам у пациенток обеих групп были сопоставимы.
Оценка эффективности лечения
Первичные исходы представлены в таблице 2. Общая частота наступления беременности в течение 6 месяцев после лечения составила 44,9% (505/1126) против 26,1% (294/1126) в I и II группах соответственно, р=0,0001.
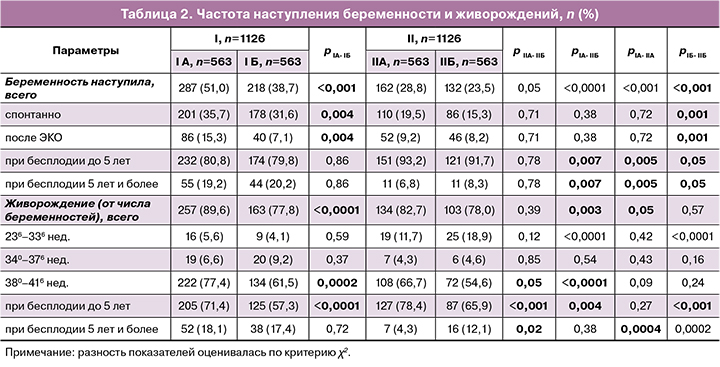
Комплексная терапия ХЭ с использованием препарата «Суперлимф» и АБ способствовала увеличению шансов наступления беременности в 1,5 раза (ОР=1,58; 95% ДИ 1,40–1,78) по сравнению с терапией без него вне зависимости от приема прогестерона.
Добавление только прогестерона к АБ-терапии без применения Суперлимфа не оказывало влияния на частоту наступления беременности, которая составила 28,8% против 23,5% (162/1126 и 132/1126 в группах IIА и IIБ соответственно, р=0,07) вне зависимости от продолжительности бесплодия (ОР=1,22; 95% ДИ 0,99–1,52). Напротив, включение препаратов Суперлимф и прогестерон в комплексную терапию несколько увеличивало шансы на наступление беременности, составив 51,0% против 38,7% без прогестерона (287/1126 и 218/1126 в группах IА и IБ соответственно, р<0,001) с ОР=1,37 (95% ДИ 1,13–1,54).
Спонтанное наступление беременности наблюдалось в I группе у 33,7% (379/1126) пациенток, во II – у 17,4% (196/1126), р=0,0001, с увеличением шанса в 2 раза соответственно (ОР=1,93; 95% ДИ 1,66–2,25); после ЭКО – у 11,2% (126/1126) и 8,5% (96/1126), р=0,04 (ОР=1,31; 95% ДИ 1,02–1,69) соответственно. Суперлимф в сочетании с прогестероном и АБ (IА) увеличивал шансы наступления беременности после ЭКО в 1,5 раза по сравнению с приемом Суперлимф/АБ (IБ) (ОР=1,48; 95% ДИ 1,12–1,95, р=0,004). Суперлимф/АБ (IБ) по сравнению с прогестероном/АБ (IIА) увеличивал шансы наступления беременности после ЭКО в 2 раза (ОР=2,01; 95% ДИ 1,57–2,57; р=0,001). То есть в программах ЭКО Суперлимф оказывал более выраженное влияние на результат, чем прогестерон. Прием прогестерона/АБ (IIА) не увеличивал шансы наступления ни спонтанной беременности, ни после ЭКО по сравнению с приемом только АБ (IIБ) (ОР=1,04; 95% ДИ 0,89–1,23 и ОР=0,92; 95% ДИ 0,67–1,67; р=0,71).
Среди пациенток с продолжительностью бесплодия до 5 лет показатель наступления беременности составил 80,4% (406/505) и 88,8% (261/294) в I и II группах соответственно (р=0,003) и был ожидаемо ниже при продолжительности бесплодия более 5 лет – 19,6% против 11,2% (99/505 и 33/294 соответственно, р<0,001). Выявлена отчетливая связь между приемом Суперлимфа/прогестерона/АБ (IА) с увеличением шансов наступления беременности почти в 3 раза у пациенток с продолжительностью бесплодия 5 лет и более по сравнению с теми, кто получал только прогестерон/АБ (IIА) – ОР=2,91 (95% ДИ 1,55–5,47). Отмечено, что добавление прогестерона к комплексу лечения у пациенток, получавших Суперлимф/АБ в группе IА, по сравнению с пациентками группы IБ не оказывало влияния на этот показатель – 19,2% против 20,2% (55/287 и 44/218 соответственно, р=0,76), ОР=0,95 (95% ДИ 0,18–1,35), если бесплодие длилось 5 и более лет.
Показатель живорождения составил в I и II группах 37,3% (420/1126) и 21,1% (237/1126) соответственно, р<0,001, с небольшим увеличением шансов на рождение живого ребенка (ОР=1,77; 95% ДИ 1,55–2,03) вне зависимости от приема прогестерона, а также при приеме Суперлимфа/прогестерона/АБ по сравнению с приемом без прогестерона (IА против IБ) (ОР=1,58; 95% ДИ 1,35–1,85), р<0,001. При рассмотрении вариантов комплексной терапии оказалось, что рождение живого ребенка в сроках 380–416 недель положительно зависело от приема Суперлимфа (IА против IIА; ОР=1,26; 95% ДИ 1,11–1,42; р=0,0002) и очень слабо зависело от прогестерона (IIА против IIБ; ОР=1,16; 95% ДИ 1,02–1,32; р=0,05). Прием Суперлимфа в прегравидарном периоде не оказывал влияния на повышение шансов на живорождение в сроках 220–336 и 340–376 недель. Ни один из изученных комплексов терапии не оказывал значимого влияния на живорождение при сроках родов менее 376 недель.
При бесплодии 5 лет и более комплексная терапия, включающая Суперлимф, была значительно более эффективна в отношении живорождений, чем без него в I против II – 17,8% (90/505) и 7,8% (23/294) соответственно (ОР=2,28; 95% ДИ 1,48–3,52; р<0,001) и IА против IIА (ОР=4,19; 95% ДИ 1,95–9,01; р<0,001); тогда как эффект не зависел от приема прогестерона как при использовании Суперлимфа, так и без него (IА против IБ; ОР=1,04; 95% ДИ 0,71–1,52; р=0,72 и IIА против IIБ; ОР=1,65; 95% ДИ 0,87–3,15; р=0,17).
Таким образом, прием Суперлимфа повышал шансы наступления беременности вне зависимости от приема прогестерона в 2,3 раза, особенно у пациенток с продолжительностью бесплодия 5 лет и более, увеличив шансы пациенток на беременность в 3,3 раза. Прием прогестерона в прегравидарном периоде у пациенток с ХЭ не способствовал наступлению беременности. Увеличение шансов на рождение живого ребенка в 2 раза отмечено при приеме Суперлимфа у пациенток с доношенной беременностью, особенно при продолжительности бесплодия 5 лет и более – более чем в 3 раза. Прием прогестерона не оказывал влияния на частоту живорождений.
Вторичные исходы представлены в таблице 3. Общая частота выкидышей в ранние и поздние сроки беременности у пациенток, получавших комплексное лечение по поводу ХЭ, составила 12,1% (61/505) против 22,1% (65/294) в I и II группах соответственно (ОР=0,55;4 95% ДИ 0,40–0,75; р=0,01). Применение прогестерона/АБ не оказывало влияния на частоту выкидышей по сравнению с только АБ (IIА и IIБ) (ОР=0,77; 95% ДИ 0,47–1,23; р=0,32).
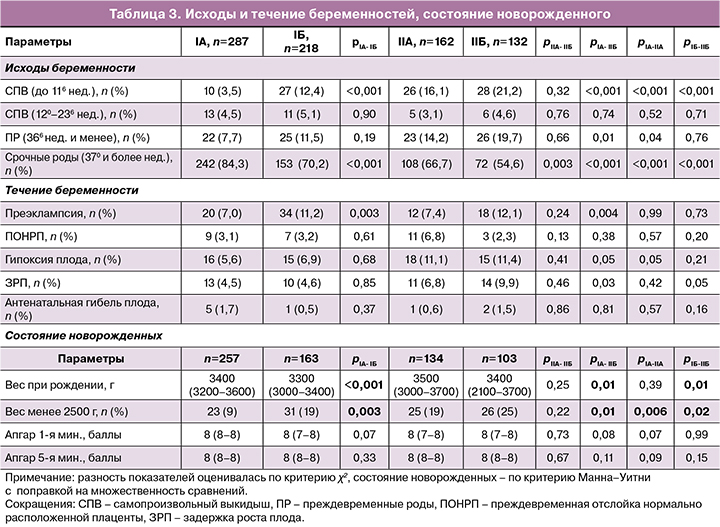
Комплексная терапия ХЭ с использованием препарата «Суперлимф», прогестерона и АБ (IА) способствовала снижению риска выкидышей в ранние сроки в 6,3 раза по сравнению с применением только АБ (IIБ) (ОР=0,16; 95% ДИ 0,08–0,33; р<0,001), в 3,6 раза – по сравнению с Суперлимфом и АБ без прогестерона (IБ) (ОР=0,28; 95% ДИ 0,14–0,57; р<0,001) и в 4,5 раза – по сравнению с прогестероном и АБ (ОР=0,22; 95% ДИ 0,11–0,44; р<0,001). Применение прогестерона/АБ (IIА) не оказывало влияния на частоту ранних выкидышей по сравнению с АБ (IIБ) (ОР=0,76; 95% ДИ 0,47–1,23; р=0,78).
На частоту самопроизвольных выкидышей в поздние сроки ни один из вариантов лечения не оказывал статистически значимого влияния.
Общая частота преждевременных родов (366 недель и менее) в I и II группах составила 9,3% (47/505) против 16,7% (49/294) соответственно, р=0,04, с уменьшением риска рождения недоношенного ребенка в почти в 2 раза (ОР=0,56; 95% ДИ 0,38–0,81). Комплексная терапия ХЭ до зачатия с использованием препаратов «Суперлимф», прогестерон и АБ уменьшала риск преждевременных родов в 2,5 раза по сравнению с только АБ (ОР=0,39; 95% ДИ 0,23–0,66; р<0,001). Другие варианты лечения не оказывали статистически значимого влияния на риск преждевременных родов.
Таким образом, прием Суперлимфа снижал риск выкидышей в 2 раза вне зависимости от приема прогестерона. Прием прогестерона не способствовал продолжению беременности. Комплексное лечение, включавшее Суперлимф, прогестерон и АБ (IА), по сравнению с АБ (IIБ) снижало риск самопроизвольных выкидышей в ранние сроки в 6 раз, преждевременных родов – 2,5 раза, но не оказывало влияния на риск поздних выкидышей.
Комплексное использование препаратов «Суперлимф», прогестерон и АБ (IА) по сравнению с АБ (IIБ) способствовало снижению риска в 2 раза преэклампсии (ОР=0,51; 95% ДИ 0,28–0,93; р=0,004), гипоксии (ОР=0,49; 95% ДИ 0,25–0,96; р=0,05) и задержки роста плода (ОР=0,43; 95% ДИ 0,21–0,88; р=0,03) (табл. 3). Риск задержки роста плода также реже наблюдался и при приме Суперлимфа/АБ без прогестерона (IБ) по сравнению с АБ (IIБ) (ОР=0,43; 95% ДИ 0,21–0,88; р=0,05). Комплекс прогестерон/АБ (IIА) по сравнению только с АБ (IIБ) не влиял на этот показатель (ОР=0,64; 95% ДИ 0,30–1,36; р=0,46).
Масса тела детей при рождении колебался от 3000 до 3700 г и в среднем был статистически значимо выше в группе IА по сравнению с другими (р<0,001 и 0,01). Частота рождения детей массой менее 2500 г в группах I и II составила 12,9% (54/420) и 21,5% (51/237) соответственно (р=0,005; ОР=0,60; 95% ДИ 0,42–0,85), что свидетельствует о снижении риска рождения маловесных детей в 1,7 раза при использовании комплекса Суперлимф/АБ независимо от приема прогестерона. Прием Суперлимфа способствовал снижению риска задержки роста плода как в комплексе с прогестероном/АБ (IА против IIБ), так и без прогестерона (IБ против IIБ) с ОР=0,41 (95% ДИ 0,24–0,49), р=0,01 и ОР=0,52 (95% ДИ 0,31–0,88), р=0,02 соответственно.
Антенатальная гибель плода не зависела от вариантов восстановительного лечения ХЭ в прегравидарном периоде.
Оценка состояния новорожденных по шкале Апгар на 1-й и 5-й минутах составила в среднем 8 баллов и не зависела от варианта прегравидарной подготовки. Неврологических нарушений у детей при рождении не отмечено в обеих группах.
Нарушения микробиоты влагалища наблюдались у большинства пациенток (90%, 2026/2252) при обследовании до лечения; после него сохранялись у небольшого их количества (18,6%, 419/2252), р<0,001 и статистически значимо не различались между группами.
Разрешение ХЭ с отсутствием плазматических клеток в микропрепарате эндометрия наблюдалось в группах I и II в 86,0% (968/1126) и 58,0% (653/1126) соответственно (р<0,001; ОР=1,61; 95% ДИ 1,52–1,71) с одновременным снижением выраженности фиброза. Уменьшение лимфоидных инфильтратов происходило в равной степени во всех группах.
Нежелательные эффекты или побочные явления, имеющие клиническое значение, были зарегистрированы только в двух наблюдениях (по одному в каждой из групп), что потребовало прекращения лечения. Оба наблюдения были связаны с выраженной реакцией желудочно-кишечного тракта на прием антибиотика (диспепсия, тошнота, рвота).
Таким образом, исходы наступивших беременностей были существенно лучше у пациенток, получавших комплексное лечение, в состав которого был включен препарат иммуномодулирующего действия «Суперлимф». Не отмечено влияния на состояние новорожденных любого из вариантов комплексного лечения ХЭ в прегравидарном периоде.
Обсуждение
Лечение женщин с маточной формой бесплодия, обусловленной ХЭ, все еще остается нерешенной проблемой, что объясняется не только сложностью патогенеза, но и до сих пор не установленными критериями диагностики ХЭ, что существенно затрудняет интерпретацию и сравнение результатов исследований, публикуемых в периодической печати. Выбор критерия диагностики ХЭ оказывает существенное влияние на показатели наступления беременности, живорождения и выкидышей. Так, при использовании наиболее строго критерия – одна или более плазматических клеток в 10 полях зрения при увеличении большой мощности (чувствительность 87,5%, специфичность 64,9%) – соответствующие показатели при ХЭ в исследовании Hirata K. et al. составили 30,8, 7,7 и 75% [8]. В систематическом обзоре и метаанализе (10 РКИ, n=4145) было показано, что негативное влияние ХЭ на исход ЭКО может быть ограничено тяжелым течением заболевания, тогда как легкое (при минимальной степени инфильтрации плазматическими клетками) – не влияет на успех ЭКО и аналогично по сравнению со здоровыми пациентками [10]. Показатели наступления беременности и живорождения после АБ-терапии ХЭ имеют существенный разброс в публикуемых исследованиях – от отсутствия разницы (в метаанализе 7 РКИ) до 76–78% и 56–66% соответственно в течение 12 месяцев наблюдения (в отдельных РКИ) у пациенток, демонстрирующих положительный ответ на АБ-лечение, и при разрешении ХЭ [9, 27–29]. В настоящем исследовании общая частота наступления беременности и живорождений в течение 6 месяцев после АБ-лечения составила 26,1 и 21,1% соответственно (без учета частоты разрешения ХЭ). При использовании препарата «Суперлимф» в комплексном лечении эти показатели составили 44,9 и 37,3%, что демонстрирует увеличение шансов в 1,58 и 1,77 раза соответственно. Сопоставимый результат применения Суперлимфа (44,2%) при той же продолжительности наблюдения был получен в исследовании Доброхотовой Ю.Э. и соавт. [30]. Важно подчеркнуть, что применение Суперлимфа в сочетании с прогестероном и АБ увеличивает шансы наступления спонтанной беременности в 2 раза, после ЭКО – в 1,5 раза и живорождений в доношенном сроке – в 1,7 раза по сравнению с применением только АБ. Прием прогестерона с АБ по сравнению только с АБ в терапии ХЭ в прегравидарном периоде не способствует увеличению частоты наступления беременности и не оказывает влияния на частоту живорождений.
Особого внимания заслуживают пациентки с продолжительностью бесплодия 5 лет и более, что сопровождается срывом компенсаторных возможностей и ожидаемо худшими результатами лечения, что и подтвердилось в настоящем исследовании. Частота наступления беременности и живорождений у них составила 11,2 и 7,8% соответственно при АБ терапии, но была статистически значимо выше – 19,6 и 17,8% при использовании Суперлимфа/АБ вне зависимости от приема прогестерона. Этот вариант лечения увеличивал шансы на живорождение в 2 раза по сравнению с лечением только АБ, а Суперлимф/прогестерон/АБ – в 3 раза по сравнению с комплексом прогестерон/АБ.
Комплексная терапия ХЭ в прегравидарном периоде с использованием препарата «Суперлимф» в комбинации с прогестероном и АБ снижала риск выкидышей в ранние сроки в 6,3 раза по сравнению только с АБ; и преждевременных родов – в 2,5 раза в отличие от лечения комплексом прогестерон/АБ, который не оказывал влияния на эти показатели.
В систематическом обзоре и метаанализе 41 исследования не было обнаружено различий между средним уровнем прогестерона в лютеиновую фазу цикла в сыворотке женщин с необъяснимым бесплодием и у здоровых, однако было показано, что сопротивление в сосудах таза было увеличено, а перфузия эндометрия и субэндометрия снижена; равно как и снижены экспрессия рецепторов прогестерона и его поглощение, что, по мнению авторов, влияет на рецептивность эндометрия [31]. Этим можно объяснить, что добавление прогестерона к комплексному лечению не оказывало влияния ни на наступление беременности, ни на ее продолжение в случаях, если она наступала. С другой стороны, под влиянием препарата «Суперлимф», по данным Ю.Э. Доброхотовой и соавт., экспрессия рецепторов к прогестерону в эпителии и строме эндометрия увеличилась в 3 и 2,7 раза соответственно [30]. Также в другой работе показано эффективное восстановление экспрессии факторов врожденного иммунитета, что приводило к купированию хронического воспаления и нормализации рецептивности ткани [32]. Кроме того, было продемонстрировано улучшение показателей ангиогенеза и васкуляризации эндометрия под влиянием препарата «Суперлимф» при ХЭ и наступление беременности у 44,2% пациенток (в течение 6 месяцев после лечения), получавших аналогичный курс лечения при длительности бесплодия от 1,5 до 9 лет [32], что совпадает с результатами, полученными в настоящем исследовании. Значимость продолжительности бесплодного периода в восстановлении репродуктивной функции подчеркивается в работе Ищенко А.И. и соавт. [33]. При течении ХЭ более 5,5 года наступает истощение компенсаторного механизма имплантационной способности эндометрия, что приводит к его гипоплазии и критичному нарушению его рецептивности. При этом, благодаря вышеописанному действию Суперлимфа, даже у этой категории пациентов удается повысить шансы на наступление беременности и живорождение в 3 и 4 раза соответственно при его приеме в комплексе с прогестероном и АБ.
Улучшение состояния эндометрия, процесса инвазии трофобласта и плацентации под влиянием комплексного лечения с использованием Суперлимфа и прогестерона способствует более благоприятному течению беременности со снижением риска преэклампсии, гипоксии и задержки роста плода в 2 раза по сравнению с лечением только АБ.
Суперлимф – средство, в состав которого входят природные цитокины в необходимой концентрации – интерлейкин-1, макрофагальный фактор, интерлейкин-6, фактор некроза опухоли α, трансформирующий ростовой фактор β и ряд минорных примесей цитокинов, хемокинов и антимикробных пептидов. Цитокины являются естественными регуляторами процесса формирования иммунитета, в том числе противовирусного [20]. При недостаточности механизмов активации клеток, которая может быть обусловлена дисбалансом выработки цитокинов, дополнительная доза приводит к усилению функциональной активности клеток иммунной системы, и наоборот, при гиперактивности – вызывает нормализацию их деятельности.
Правильность выбранной нами стратегии коррекции иммунного статуса пациенток, страдающих ХЭ, с применением средства локальной иммуномодулирующей терапии комплексом экзогенных цитокинов подтверждается высокой эффективностью лечения. Это также подтверждается результатами иммуногистохимического исследования, выполненного Тапильской Н.И. и соавт. [23], которые продемонстрировали снижение количества цитотоксических Т-лимфоцитов (CD8+), В-лимфоцитов (CD20+) в стромальном компоненте эндометрия с мелкоочаговым расположением клеток в 81,3% случаев и увеличение Т-хелперов (СD4+), что свидетельствует о существенном снижении признаков ХЭ, более выраженном, по сравнению с группой получавших АБ терапию.
Заключение
Таким образом, использование препарата «Суперлимф», модулирующего активность цитокинов, позволяет улучшить результаты лечения пациенток с ХЭ и бесплодием.
Лечение ХЭ с использованием препарата «Суперлимф» в дозе 25 ЕД курсом 20 дней одновременно с АБ (10 дней) и прогестероном во вторую фазу цикла (3–6 месяцев) в прегравидарном периоде обладает высокой клинической эффективностью и увеличивает шансы наступления беременностей с улучшением их исходов – снижением частоты преэклампсии, гипоксии и задержки роста плода, самопроизвольных выкидышей в ранние сроки, преждевременных родов и увеличением шансов для живорождений по сравнению с пациентками, получавшими только АБ терапию.



