Проблема сахарного диабета (СД) остается одной из наиболее актуальных медико-социальных проблем современности, что обусловлено широким распространением данного заболевания практически во всех странах мира, тенденцией к увеличению его частоты, тяжестью многочисленных осложнений, трудно поддающихся лечению, основными из которых являются сосудистые нарушения. По данным литературы, в настоящее время от сосудистых поражений погибает 65–80% пациентов с различными типами СД. Многие авторы и эксперты включают поражение сосудов в определение самого заболевания, так как начинается СД как болезнь обмена, а заканчивается как генерализованная сосудистая патология [1–5].
Рост заболеваемости СД, наметившаяся тенденция к его «омоложению», тяжесть сосудистых осложнений, сопутствующих этой патологии, сделали особенно актуальной проблему ведения беременности у этого контингента больных и выхаживания их новорожденных детей. Несмотря на широкое внедрение новых высокоочищенных видов инсулинов, методов самоконтроля и мониторинга состояния углеводного обмена, организации акушерских отделений, специализированных по СД, у пациенток с СД остается высокой перинатальная заболеваемость и смертность новорожденных детей (10–40%) [2, 4, 6, 7].
По данным литературы, у беременных с СД были обнаружены изменения сосудов маточно-плацентарного русла по типу ангиопатических, характерных для СД, что создает предпосылки для формирования хронических форм плацентарной недостаточности, а, следовательно, и внутриутробной гипоксии плода[2, 4, 7].
По данным нашего исследования, частота формирования хронической перинатальной ишемии новорожденных у пациенток с различными типами СД вдвое превосходила частоту формирования диабетической фетопатии у данного контингента больных. Это не зависело, как от степени компенсации углеводных нарушений, так и от типа СД.
Данное положение позволило нам определить хроническую перинатальную ишемию новорожденных у матерей с СД как основной фактор, определяющий перинатальный прогноз.
По современным представлениям патогенез осложнений СД рассматривается с позиций теории глюкозотоксичности, согласно которой хронически повышенный уровень глюкозы крови является ведущим фактором, инициирующим многообразные биохимические и структурные изменения в клетках и тканях [7–10]. Считается, что при СД основным патогенетическим механизмом развития ангиопатий является гликозилирование сосудистой стенки [3–5].
По классификации З.С. Баркагана, СД входит в VIII группу гематогенных тромбофилий, связанных с нарушениями различных компонентов системы гемостаза, вследствие изменения обмена веществ и биохимического состава крови [1].
Однако, по данным других авторов, влияние гипергликемии не является приоритетным в формировании диабетических повреждений сосудов. Показано, что более чем у 20% больных СД ангиопатии не обнаруживаются даже при чрезвычайно плохой компенсации метаболических нарушений. Эти больные по каким-то причинам невосприимчивы к токсическому воздействию гипергликемии [4, 6].
Поэтому весьма обоснованными представляются поиски различных генетических факторов, обеспечивающих большую или меньшую восприимчивость микрососудистого русла органов-мишеней к воздействию метаболических и/или гемодинамических факторов при СД.
В связи с этим, целью нашего исследования явилось изучение особенностей молекулярно-генетических механизмов регуляции системы гемостаза у пациенток с СД.
Материал и методы исследования
Для достижения поставленной цели на наличие полиморфизма генов, кодирующих агрегантное состояние крови и фолатный обмен, были обследованы 110 пациенток в 3-м триместре беременности, страдающих различными типами СД. В зависимости от перинатальных исходов все пациентки были разделены на 2 группы: Основную (n=71), которую составили пациентки, у новорожденных которых были диагностированы гипоксически-ишемические поражения центральной нервной системы в раннем неонатальном периоде, и группу сравнения (n=39), которую составили пациентки, новорожденные которых не имели указанных поражений.
Исследование генетических полиморфизмов, ассоциированных с риском развития тромбофилии (генов агрегантного состояния крови и фолатного обмена) проводилось методом полимеразно-цепной реакции (ПЦР) в режиме реального времени с использованием детектирующего амплификатора ДТ-96 с автоматическим программным обеспечением (ООО «НПО ДНК-Технология»). Образцы ДНК получали из клеток буккального эпителия.
Анализ проводился по полиморфным вариантам генов системы факторов свертывания крови (F51691G>A, F220210G>A, FGB455 G>A), системы фибринолиза (PAI-1 5G>4G), системы гликопротеинов тромбоцитарных рецепторов (ITGA2 807C>T, ITGB3 1565T>C), ферментов цикла обмена гомоцистеина (MTR 2756A>G, MTRR 66A>G, MTHFR 677С>Т, MTHFR 1298A>C). Выбор полиморфных локусов определялся описанной в литературе наибольшей информативностью влияния указанных мутаций на степень декомпенсации гемостазиологических нарушений [2, 4, 6].
Статистическая обработка материала проводилась с помощью пакета прикладных программ Microsoft Excel. Для проверки соответствия наблюдаемого распределения частот генотипов теоретически ожидаемому равновесному распределению по закону Харди–Вайнберга использовался критерий χ2.
Результаты исследования и обсуждение
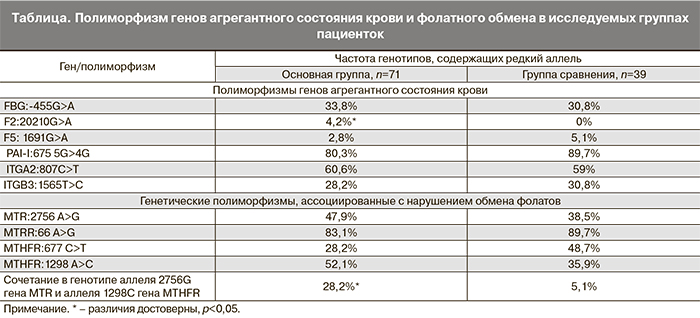
Изучена частота встречаемости генотипов, содержащих редкий аллель, в полиморфных локусах генов F5:1691G>A, F2: 20210G>A, FGB: 455 G>A , PAI-1: 5G>4G, ITGA2: 807C>T, ITGB3 1565T>C, MTR 2756A>G, MTRR 66A>G, MTHFR 677С>Т и MTHFR 1298A>C у женщин основной группы и группы сравнения. Распределение частот генотипов исследуемых генов соответствовало распределению Харди–Вайнберга (p>0,05).
На основании проведенного исследования, наличие генетической предрасположенности к формированию тромбозов было отмечено у всех пациенток (таблица).
Так мутация гена протромбина (F2) у пациенток с формированием перинатальной ишемии новорожденных (основная группа) встречалась в 4,2%, при полном отсутствии таковой в группе сравнения (p<0,05). По данным литературы, эта мутация достаточно редко встречается в популяции (1–4%) и ассоциирована с невынашиванием беременности, фетоплацентарной недостаточностью, задержкой развития плода, отслойкой плаценты [7, 11].
Напротив, частота встречаемости Лейденской мутации (F5) у пациенток основной группы была реже, чем у пациенток группы сравнения (2,8 и 5,1% соответственно, при p>0,05). Полученные данные не противоречат результатам мировых исследований. Распространенность Лейденской мутации среди здоровых лиц в Европе и США колеблется от 3 до 7%, а в некоторых популяциях может достигать 15% [11].
Достоверных различий в частоте встречаемости генотипов, содержащих аллель «риска», по полиморфным вариантам генов фибриногена (FBG), ингибитора активатора плазминогена 1-го типа (PAI-1), гликопротеинов тромбоцитарных рецепторов (ITGA2 и ITGB3) в исследуемых группах выявлено не было.
Неравнозначные результаты по группам исследования были получены и при изучении полиморфизмов генов, ассоциированных с нарушением обмена фолатов: так, полиморфизм метионин-синтазы (MTR A2756G) статистически чаще – 47,9% случаев встречался у пациенток основной группы, по сравнению с пациентками группы сравнения (38,5%), p<0,05.
Встречаемость генетического полиморфизма метионин – синтазы редуктазы (MTRR A66G) была относительно высокой в обеих исследуемых группах и составила 83,1 и 89,7% случаев соответственно. Такую высокую встречаемость данного полиморфизма можно объяснить большой распространенностью его в популяции.
Аллель Т гена метилентетрагидрофолатредуктазы (MTHFR) в положении 677 у пациенток в основной группе встречался в 28,2% случаев, а у пациенток в группе сравнения – в 48,7% (p>0,05). Также было выявлено, что полиморфный аллель 677T у пациенток в группе сравнения в 90% случаев встречался в состоянии гетерозиготы, что приводит к менее выраженному снижению активности фермента. По данным ряда авторов, около половины населения в мире являются гетерозиготными носителями полиморфизма С677Т гена MTHFR [6, 8, 9, 11]. Тогда как у пациенток основной группы мутантный аллель 677T в 30% случаев встречался в гомозиготном состоянии. По данным литературных источников частота гомозигот 677ТТ варьирует в различных регионах Российской Федерации в пределах 4,6–13% [5, 11–14].
Полиморфизм гена MTHFR в положении A1298C чаще встречался у пациенток основной группы – в 52,1% случаев, чем у пациенток в группе сравнения – в 35,9% (p<0,05).
Таким образом, из четырех исследуемых полиморфизмов в генах, кодирующих состояние ферментов фолатного каскада, у пациенток основной группы были выявлены три, встречаемость которых в данной группе была высокой – MTR A2756G, MTRR A66G и MTHFR A1298C (p<0,05).
При наличии полиморфных вариантов по нескольким генам одной функциональной сети возможен аддитивный эффект, когда многочисленные незначительные изменения в итоге обуславливают качественно новое проявление фенотипа [8, 9, 13]. Поэтому мы провели сочетанный анализ носительства полиморфных вариантов генов фолатного обмена в исследуемых группах пациенток. Достоверные отличия были получены по сочетанию полиморфизма MTHFR A1298C с наличием полиморфизма MTR A2756G. Частота встречаемости такого генотипа составила 28,2%, против 5,1% у пациенток в группе сравнения (p<0,05). Важно заметить, что в данном сочетании мутантный аллель 1298С в 60% случаев находился в гомозиготном состоянии.
Проведенный анализ позволяет предположить, что у женщин, имеющих в генотипе полиморфные варианты обоих указанных генов, возможно развитие ситуации, при которой снижена функциональная активность двух ферментов: метилентетрагидрофолатредуктазы, катализируещей превращение 5, 10-метилентетрагидрофолата в 5-метилентетрагидрофолат при участии фолиевой кислоты, как ко-фактора, и метионин-синтазы-редуктазы, осуществляющей метилирование гомоцистеина в присутствии ко-фактора кобаламина (витамин В12). В результате возможно развитие гипергомоцистеинемии на фоне дефицита фолатов и/или кобаламина с последующим риском развития тромбообразования.
Выводы
- Генетически детерминированные дефекты гемостаза у беременных с СД являются прогностически значимыми для формирования хронической перинатальной ишемии новорожденных.
- Предикторами риска развития данных повреждений являются полиморфизмы в гене протромбина: F220210G>A и фолатного цикла: MTR A2756G, MTRR A66G и MTHFR A1298C, а также сочетание в генотипе аллелей 2756G гена MTR и 1298C гена MTHFR.
- С целью улучшения перинатальных исходов у беременных с СД необходимо своевременное выявление генетических полиморфизмов и коррекция ассоциированных с ними нарушений гемокоагуляции.



